Accesele de furie şi evenimentele cardiovasculare
Autori:
Dr. Ruxandra Deliu
Spitalul Clinic Judeţean de Urgenţă Craiova
Dr. Adrian Mereuţă
IUBCV "CC Iliescu" Bucureşti
Ateroscleroza o boală difuză şi progresivă, astfel încât peste 80% din adulţii de vârstă mijlocie au un grad de ateroscleroză coronariană.1 Şi totuşi incidenţa sindromului coronarian acut la populaţia de peste 40 de ani este sub 1%.2 Mai mult, deşi ruptura plăcii aterosclerotice complicată cu tromboză ocluzivă este cauza cea mai frecventă a sindromului coronarian acut, în cele mai multe cazuri ruptura plăcii complicată de tromboză nu duce la evenimente clinice, ci determină doar creşterea stenozei coronariene.3 Pentru că pentru producerea unui eveniment coronarian trebuie să fie îndeplinite simultan un număr de condiţii („furtună perfectă”): existenţa unei plăci aterosclerotice vulnerabile, un flux coronarian anormal, o funcţie plachetară exagerată, inflamaţie, un dezechilibru neurohormonal (depresie, exces de catecolamine, etc.) şi un factor declanşator (stresul, de exemplu).2 Cunoaşterea acestor factori permite o abordare mai largă în prevenţia cardiopatiei ischemice ce poate duce la creşterea eficienţei acesteia.
În ultimii ani, au început să prindă contur ideile conform cărora, pe lângă factorii de risc cardiovascular clasici, cu efecte pe termen lung, exista mulți alți factori de risc cardiovascular „neconvenționali”, cu efect pe termen lung sau scurt. Pe măsură ce unii factori de risc neconvenționali precum turele de noapte efectuate la locul de munca au devenit recunoscuți, au fost luaţi în considerare şi alți factori de risc.
În acest sens, o ipoteză interesantă conform căreia episoadele de furie pot fi declanșatori de evenimente cardiovasculare a fost studiată din mai multe perspective. Echipa condusă de Elisabeth Mostofsky a realizat un review sistematic publicat în European Heart Journal în 2014, în ceea ce privește furia ca factor trigger tranzitor pentru evenimente cardiovasculare, precum infarct miocardic/sindrom coronarian acut, accident vascular cerebral (AVC) ischemic sau hemoragic sau aritmii ventriculare, în care au fost evaluate 9 studii case-crossover, pornind de la ipoteza că episoade scurte de mânie pot declanșa aceste evenimente cardiovasculare.4 Deși unele dintre studii au fost făcute pe eșantioane mici și heterogene în ceea ce privește populația și cutoff-ul folosit, acest review a reușit să expună rezultate pertinente după o prelucrare statistică completă a peste 5000 de cazuri.
Rezultatele privind incidența infarctului miocardic sugerează că riscul este semnificativ mai mare in perioada următoare crizei de furie, fiind mai puternice în studiile cu evenimente incidente decât în cele care au inclus și evenimente recurente.
Luând în discuție accidentele cerebrale ischemice, rezultatele meta-analizei efectuate au conchis că riscul de AVC ischemic pe o perioadă de două ore după declanșarea episodului de furie este de 3,6 ori mai mare decât în alte situații (p=0,09). Unul dintre studiile incluse a evaluat riscul de ruptură a anevrismului cerebral în aceleași condiții, raportând un risc de 6,3 ori mai mare în ora imediat următoare.
În ceea ce privește incidența aritmiilor cardiace, în studiul multicentric prospectiv efectuat pe mai mult de 1100 de pacienți cu defibrilator implantat, în care aceștia au fost interogați despre episoadele de furie din ora precedentă administrării șocului electric, rezultatele au fost evocatoare, cu o rată de tahicardie ventriculară sau fibrilație ventriculară în ora următoare unui episod de furie moderată de 3,2 ori mai mare decât în condiții obișnuite și de 16,7 ori mai mare după furie intensă. În același sens, un studiu de dimensiuni mai mici, efectuat pe pacienți cu defibrilator intracardiac, în care aceștia au fost intervievați în legătura cu emoțiile lor pe parcursul a 2 ore înainte de primirea șocului electric, a descris o rată de apariție a aritmiilor maligne de 1,8 ori mai mare în primele 15 minute după episodul de furie și de 1,35 ori mai mare în perioada 15 min-2 ore.
Deși riscul relativ de evenimente cardiovasculare declanșate de episoadele de furie este ridicat, după cum s-a demonstrat statistic, totuși riscul absolut nu este foarte ridicat datorită faptului că augmentarea riscului cardiovascular este tranzitorie și depinde de perioada de expunere la factorul de risc. În toate cazurile, riscul absolut individual este cu atât mai mare cu cât riscul cardiovascular de bază este mai mare și cu cât episoadele de furie sunt mai frecvente.
Toate studiile din meta-analiză au folosit scala de mânie numită Onset Anger Scale, dar au avut diferite cutoff-uri; totuși a fost demonstrată o puternică asociere a furiei cu evenimentele cardiovasculare, cât și o creștere a riscului cu nivelul intensității furiei.
Unele studii susțin că tratamentul cu betablocante, aspirină, nitrați, scade riscul determinat de ieșirile de furie.5-9 Un studiu din 1999, efectuat de un colectiv din Stocholm condus de Jette Möller, a raportat o incidență mai scăzută a infarctului miocardic legat de accesul de mânie la pacienții cu accese mai frecvente și la cei care își manifestă furia.10
Mecanismele potențiale prin care furia și evenimentele cardiovasculare sunt legate sunt multiple, la baza cărora stă activarea sistemului nervos simpatic cu creșterea frecvenței cardiace și rezistenței vasculare. Schimbările hemodinamice rapide pot cauza ischemie tranzitorie și ruperea plăcilor de aterom vulnerabile. De asemenea, cascada de evenimente cauzată de activarea simpatică, cuprinzând răspunsul inflamator, proagregarea plachetară, creșterea vâscozității plasmei, duce la creșterea probabilității de ocluzie trombotică a unei plăci vulnerabile rezultând într-un eveniment coronarian (“furtuna perfectă”).
Una dintre concluziile meta-analizei discutate a fost că efectele acceselor de furie, deși tranzitorii, se pot acumula cu cât sunt mai frecvente, ducând la un impact clinic mai mare. Pe de altă parte, factorii de risc cardiovascular „clasici” sau existența unei boli cardiovasculare cresc riscul apariției unui eveniment pe perioada accesului de furie și orele următoare, cu alte cuvinte factorii de risc clasici cresc impactul absolut pe care îl are episodul de furie.
În concluzie, există o legătură demonstrată între episoadele de furie și evenimente cardiovasculare – infarct miocardic acut, aritmie ventriculară sau AVC – cu efectul cel mai pronunțat în următoarele două ore după accesul de furie. Deși studiile care au testat această asociere sunt puține, heterogene, iar rezultatele lor au demonstrat diverse nivele de asociere, totuși ipoteza este confirmată de toate, iar nivelul de evidenţă este consistent.
Bibliografie
1. Arbab-Zadeh A, Nakano M, Virmani R, Fuster V. Acute coronary events. Circulation. 2012 March 6; 125(9): 1147–1156.
2. Burg MM, Edmonson D, Shimbo D, et al. The ‘Perfect Storm’ and acute coronary syndrome onset: Do psychosocial factors play a role? Prog Cardiovasc Dis. 2013; 55(6): 601-610.
3. Davies MJ. The contribution of thrombosis to the clinical expression of coronary atherosclerosis. Thromb Res 1996; 82(1): 1-32.
4. Mostofsky E, Penner EA, Mittleman MA. Outbursts of anger as a trigger of acute cardiovascular events: a systematic review and meta-analysis. European Heart Journal 2014; 35: 1404–1410.
5. Mittleman MA, Maclure M, Sherwood JB, et al. Triggering of acute myocardial infarction onset by episodes of anger. Determinants of Myocardial Infarction Onset Study Investigators. Circulation 1995; 92: 1720–1725.
6. Mostofsky E, Maclure M, Tofler GH, Muller JE, Mittleman MA. Relation of outbursts of anger and risk of acute myocardial infarction. Am J Cardiol 2013; 112: 343–348.
7. Lipovetzky N, Hod H, Roth A, Kishon Y, Sclarovsky S, Green MS. Emotional events and anger at the workplace as triggers for a first event of the acute coronary syndrome: a case-crossover study. Isr Med Assoc J 2007; 9: 310–315.
8. Koton S, Tanne D, Bornstein NM, Green MS. Triggering risk factors for ischemic stroke: a case-crossover study. Neurology 2004; 63: 2006–2010.
9. Culic V, Eterovic D, Miric D, Rumboldt Z, Hozo I. Gender differences in triggering of acute myocardial infarction. Am J Cardiol 2000; 85: 753–756, A758.
10. Moller J, Hallqvist J, Diderichsen F, TheorellT, Reuterwall C, Ahlbom A. Do episodes of anger trigger myocardial infarction? A case-crossover analysis in the Stockholm Heart Epidemiology Program (SHEEP). Psychosom Med 1999; 61: 842–849.

Lucrarea vorbește despre strânsa legatură dintre emoțiile negative ale pacienților cardiaci și evoluția bolii cardiace. Actualitatea subiectului își regăsește ecou în instalarea patologiei cardiace, în sensul că izbucnirile emoționale puternice, cum ar fi furia, sunt mai des întâlnite la pacienții cardiaci.
Furia constituie un factor de risc pentru sănătatea inimii, sentimentele negative pe care le resimt pacienții cardiaci sunt frecvent observabile în cadrul consilierii psihologice.
De cele mai multe ori doctorul curant observă, în urma anamnezei pacientului, o serie de excitații emoționale care pot fi manifestate sub forma agitației, anxietății, furiei, cum ar fi: schimbarea expresivității faciale-grimase, inflexiuni ale vocii-debit verbal ridicat, neluarea în considerare a dorințelor celor din jur, exprimarea inadecvată a gândurilor, lipsa alternativelor, expectanțe negative asupra viitorului, incapacitatea menținerii unor relații interpersonale optime, acuze somatice multiple, vulnerabilitate față de moarte, teama față de actul medical. Se recomandă ca, atunci când recunoaște caracteristicile enumerate mai sus, doctorul să abordeze un ton plăcut, dar ferm. Comunicarea să fie concepută într-un mod precis, clar, să aștepte momentul potrivit pentru a începe discuția, să stabilească un contact vizual optim cu pacientul și o relație empatică. De asemenea, este important să intercaleze mesaje scurte pentru încurajarea pacientului spre o comunicare sinceră, să sincronizeze mesajele verbale și non-verbale, în așa fel încât să exprime același lucru. Doctorul oferă sfaturi sau rezolvări doar dacă i se cer. În urma acestor constatări, îi recomandă pacientului său o întrevedere cu doctorul psihiatru pentru prescrierea sedativelor necesare și cu psihologul clinician pentru gestionarea comunicării și ventilarea emoțiilor, adesea de natură psiho-organică.
Studiul contribuie la ințelegerea mai profundă a relației de interdependență dintre minte și corp, atrăgând atenția asupra importanței relației psihologice dintre medic și pacient
Psiholog clinician, Elena Marinescu IUBCV „CC Iliescu” Bucureşti
Semnificaţia lactatului la pacientul acut cardiac
Autor: Dr. Adrian Mereuţă, Roxana Ciobotaru
IUBCV "CC Iliescu" Bucureşti
Valoarea lactatului seric este utilizată în practica clinică pentru a cuantifica severitatea şi răspunsul la tratament la pacientul în stare critică. Încă din 1964, Broder şi Weil au observat că o valoare a lactatului de peste 4 mmol/l se asociază cu prognostic nefavorabil la pacientul în şoc de orice etiologie.1 În cardiologie, lactatul este utilizat în estimarea prognosticului în sindromul coronarian acut, şocul cardiogen, stopul cardiorespirator.
Lactatul este baza acidului lactic şi este produs în majoritatea celulelor, fiind implicat în metabolismul energetic. În mod normal, în organism există 2 sisteme prin care se generează energia: glicoliza şi fosforilarea oxidativă. Glicoliza nu necesită prezenţa oxigenului, produce o cantitate mai mică de energie şi are ca produs final lactatul. Pe de altă parte, lactatul se poate converti în piruvat (există un raport constant lactat/piruvat de 10/1), moleculă care, prin acetilcoenzima A, intră în ciclul Krebs şi iniţiază fosforilarea oxidativă ce produce energie semnificativ mai mare faţă de glicoliză.2,3 Deci, lactatul acţionează ca o placă turnantă între metabolismul anaerob şi aerob: 20% este convertit în glucoză prin neoglucogeneză în ficat (70%) şi în rinichi (30%) – metabolism anaerob, 50% este folosit local ca sursă de energie prin metbolism aerob, iar restul rămâne în sânge ca rezervă de energie.2,4 Producţia lactatului în muşchi şi metabolizarea lui în ficat şi rinichi formează ciclul Cori. (Figura 1)
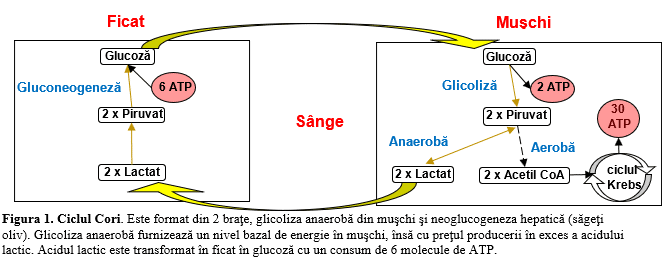
Ciclul Cori furnizează organismului două resurse energetice importante pentru organism: lactatul şi glucoza, a căror importanţă creşte în condiţii de stres, hipoxie sau malnutriţie. Prin gluconeogeneză, organismul reuşeşte să-şi menţină un nivel acceptabil al glucozei sanguine chiar în lipsa aportului alimentar: un studiu pe voluntari sănătoşi arată că contribuţia ciclului Cori la gluconeogeneză creşte de la 41% la 92% în lipsa oricărui aport alimentar timp de 40 de ore.5
Metabolismul energetic al cordului se bazează, în repaus, pe β-oxidarea acizilor graşi până la acetilcoenzima A care (prin intermediul ciclului Krebs) furnizează 60-90% din moleculele de adenozin trifosfat (ATP), celelalte 10-40% molecule de ATP fiind furnizate de glicoliza aerobă (tot prin intermediul ciclului Krebs).6 (Figura 1) În condiţii de stres şi suprasolicitare, sub efectul stimulării β-adrenergice, oxidarea acizilor graşi trece pe plan secund pentru că este mai puţin eficientă, iar lactatul devine principalul combustibil cardiac, ajungând să asigure până la 60% din metabolismul energetic.6 Studiile pe animale de laborator au arătat că, în condiţii de şoc, depleţia lactatului este asociată cu evoluţie nefavorabilă şi deces, pe când aportul de lactat îmbunătăţeşte performanţa cardiacă.6-8 În acest fel, hiperlactemia poate fi apreciată nu ca o consecinţă a hipoxiei celulare, ci ca parte a răspunsului la stres, împreună cu hipersimpaticotonia, glicoliza şi accelerarea metabolismului.2,6 Deci, creşterea lactatului seric nu reprezintă un factor cauzator al prognosticului nefavorabil, ci un indicator al stresului metabolic intens prin care organismul încearcă să se salveze dintr-o situaţie critică.
Valoarea normală a lactatului seric nu este clar stabilită, însă majoritatea studiilor stabilesc, pentru pacientul critic, o valoare limită de 2 mmol/l, iar hiperlactemia este considerată la o valoare > 4 mmol/l. Acidoza lactică înseamnă că, pe lângă hiperlactemie, există şi acidoză, adică un pH < 7,35. Pentru că nu există diferenţe între valorile lactatului determinate din probe recoltate din sângele arterial sau din cel venos, recoltarea venoasă este suficientă. Se recomandă ca proba să fie analizată în maxim 15-30 de minute din momentul recoltării, pentru a se evita false creşteri ale lactemiei.
Valoarea lactatului este importantă, însă evoluţia acestei valori este şi mai sugestivă pentru prognostic: clerance-ul < 10% în 12 ore sau < 70% în 48 ore este asociat cu cel mai rău prognostic.6
În cardiologie, valoarea lactatului seric este folosită pentru prognostic în primul rând la pacienţii post-stop cardiorespirator sau în şoc.
După stopul cardiorespirator, lactatul seric este relevant pentru prognostic, mortalitatea fiind proporţională cu valoarea acestuia. Într-un studiu pe 128 pacienţi cu stop cardiorespirator în afara spitalului, s-a constatat că pacienţii cu lactat seric < 5 mmol/l au avut o mortalitate de 39%, cei cu lactat 5-10 mmol/l, 67%, iar cei cu lactat > 10 mmol/l, 92%.9 Mai mult, lactatul crescut, măsurat la 1 oră după revenirea circulaţiei spontane, este relevant nu numai pentru mortalitatea precoce, ci şi pentru complicaţiile neurologice post-stop cardiorespirator; pe de altă parte, scăderea lactatului la 12 ore anunţă un prognostic neurologic favorabil.6,10 De menţionat că hipotermia determină la inducţie o creştere a lactatului, care însă ulterior scade.6
În şocul cardiogen, hiperlactemia > 6,5 mmol/l a fost strâns asociată cu mortalitatea intraspitalicească.11 Pe de altă parte, creşterea presiunii arteriale medii, prin utilizarea noradrenalinei, a fost asociată cu scăderea lactatului, creşterea performanţei cardiace şi îmbunătăţirea prognosticului.12 Lactatul crescut din şoc este expresia hipoperfuziei tisulare, dar şi a reacţiei de răspuns la stres al organismului.2,6
Valoarea predictivă a hiperlactemiei a fost studiată şi în sindromul coronarian acut şi insuficienţa cardiacă. Hiperlactemia > 2 mmol/l la pacienţii cu STEMI identifică o categorie de pacienţi cu risc crescut de deces şi complicaţii hemodinamice.6 În insuficienţa cardiacă acută, hiperlactemia > 3,2 mmol/l a fost asociată cu creşterea mortalităţii, indiferent de etiologia ischemică sau neischemică a insuficienţei cardiace.13
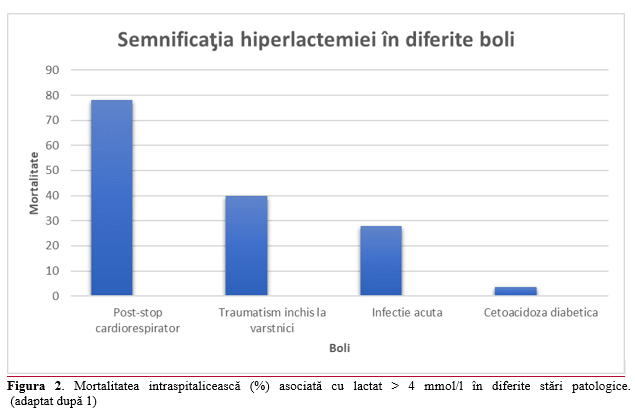
Asocierea constantă dintre lactat şi prognostic a determinat ca acesta să fie măsurat la categorii din ce în ce mai largi de pacienţi. S-a observat că lactatul este crescut în toate tipurile de şoc (relaţia clară cu prognosticul fiind aceeaşi ca în şocul cardiogen), sepsis, traumatisme, convulsii, ischemie mezenterică, arsuri, leucemie, astm bronşic, cetoacidoză diabetică sau efort muscular exagerat (febră musculară). (Figura 2) Deşi în multe dintre aceste stări lactatul seric crescut este asociat cu un prognostic mai prost, relaţia este mai puţin clară decât în şoc şi stop cardiorespirator. De remarcat că, în cetoacidoza diabetică, lactatul > 4 mmol/l nu arată un prognostic mai nefavorabil faţă de cei cu lactatul mai mic. Dealtfel, în această patologie, creşterea lactatului nu este datorată hipoperfuziei, ci alterărilor metabolice.1 Evident că hiperlactemia produsă de un efort muscular exagerat (febră musculară, astm, convulsii) nu reprezintă un indicator prognostic.
În concluzie, lactatul este o moleculă cheie în metabolismul energetic al organismului. Creşterea concentaţiei lui serice poate fi determinată de hipoperfuzia tisulară, dar de regulă este parte din răspunsul la stres al organismului şi reprezintă un indicator prognostic important la pacientul critic cardiac, în special în şocul cardiogen şi post-stop cardiorespirator. Este uşor de măsurat pe analizatoare rapide aflate în camera de gardă sau departamente de terapie intensivă, ceea ce îl face foarte util în triajul pacienţilor critici.
Bibliografie
1. Andersen LW, Mackenhauer J, Roberts JC, Berg KM, Cocchi MN. Etiology and therapeutic approach to elevated lactate. Mayo Clin Proc. 2013; 88(10): 1127–1140.
2. Garcia-Alvarez M, Marik P, Bellomo R. Stress hyperlactataemia: present understanding and controversy. Lancet Diabetes Endocrinol 2014; 2: 339–47.
3. Ferguson BS, Rogatzki MJ, Goodwin ML, Kane DA, Rightmire Z, Gladden LB. Lactate metabolism: historical context, prior misinterpretations, and current understanding. Eur J Appl Physiol. 2018 Jan 10. doi: 10.1007/s00421-017-3795-6. [Epub ahead of print]
4. Revelly JP, Tappy L, Martinez A, et al. Lactate and glucose metabolism in severe sepsis and cardiogenic shock. Crit Care Med 2005; 33: 2235-2240.
5. Katz J, Tayek JA. Gluconeogenesis and the Cori cycle in 12-, 20-, and 40-h-fasted humans. Am J Physiol. 1998; 275(3 Pt 1): E537-42.
6. Lazzeri C, Valente S, Chiostri M, Gensini GF. Clinical significance of lactate in acute cardiac patients. World J Cardiol 2015; 7(8): 483-489.
7. Barbee RW, Kline JA, Watts JA. Depletion of lactate by dichloroaxetate reduces cardiac efficiency after hemorrhagic shock. Shock 2000: 14: 208-214.
8. Levy B, Mansart A, Montemont C, et al. Myocardial lactate deprivation is associated with decreased cardiovascular performance, decreased myocardial energetics and early death in endotoxic shock. Intensive Care Med 2007; 33: 495-502.
9. Cocchi MN, Miller J, Hunziker S, et al. The association of lactate and vasopressor need for mortality prediction in survivors of cardiac arrest. Minerva Anestesiol 2011; 77: 1063-1071.
10. Kaji AH, Hanif AM, Bosson N, Ostermayer D, Niemann JT. Predictors of neurologic outcome in patients resuscitated from out-of-hospital cardiac arrest using classification and regression tree analysis. Am J Cardiol 2014; 114: 1024-1028.
11. Valente S, Lazzeri C, Vecchio S, et al. Predictors of in-hospital mortality after percutaneous coronary intervention for cardiogenic shock. Int J Cardiol 2007; 114: 176-182.
12. Perez P, Kimmoun A, Blime V, Levy B. Increasing mean arterial pressure in cardiogenic shock secondary to myocardial infarction: effects on hemodynamics and tissue oxygenation. Shock 2014; 41: 269-274.
13. Kawase T, Toyofuku M, Higashihara T, et al. Validation of lactate level as a predictor of early mortality in acute decompensated heart failure patients who entered intensive care unit. J Cardiol. 2015; 65: 164–170.

S-a observat că, în cazul intervenţiilor în urgenţă de bypass aortocoronarian la pacienţii cu infarct acut de miocard complicat cu şoc cardiogen, o valoare a lactatului preoperator > 4 mmol/L are o valoare predictivă independentă pentru mortalitatea intraspitalicească. Valoarea e mai importantă decât resuscitarea preoperatorie sau necesarul de inotrop. Valoarea de cutoff încă nu e stabilită. Această valoare crescută preoperator poate fi datorată unei zone mari de miocard la risc, afectării severe a funcţiei ventriculului stâng şi instabilităţii hemodinamice sau întârzierii efectuării procedurii chirurgicale (Davierwala, 2016))
La pacienţii critici aparent stabilizaţi clinic, lactatul crescut trebuie interpretat ca un semnal de alarmă în prezenţa parametrilor hemodinamici stabili. Probabil că măsurarea lactatului trebuie acompaniată şi de monitorizarea saturaţiei venoase centrale, ca paramentru de ofertă şi consum de oxigen. (Bakker, 2013)
Dr. Luchian Mihail, medic primar ATI, IUBCV « CC Iliescu »
Betablocantele în infarctul miocardic acut
Istoria indicaţiilor de tratament în 3 studii şi 4 metaanalize
Autor: Dr. Adrian Mereuţă
IUBCV "CC Iliescu" Bucureşti
Până în anii ‘60, cardiopatia ischemică beneficia de un tratament foarte limitat: angina era tratată doar cu nitroglicerină, iar infarctul miocardic cu oxigen şi repaus la pat, mortalitatea datorată infarctului fiind de 30% la o lună.1 Însă pe măsură ce mecanismul ischemiei miocardice a fost descifrat, medicamentele şi metodele terapeutice noi şi-au dovedit eficienţa şi au dus la scăderea spectaculoasă a mortalităţii datorate cardiopatiei ischemice.2
Antagoniştii receptorilor beta-adrenergici au fost inventaţi în mod special pentru a trata ischemia miocardică prin scăderea consumului de oxigen în condiţiile unui aport deficitar.3 Pentru că, după multe teorii greşite, legatura dintre hipoxia miocardică şi angină a devenit în sfârşit clară spre 1930, iar Raymond Alquist a descris, într-un articol revoluţionar, în 1948, receptorii α şi β asupra cărora acţionează hormonii adrenergici.3,4
Betablocantele au fost folosite în cardiopatia ischemică imediat după ce au fost descoperite, în 1960. Iar rezultatele au fost spectaculoase, prevenirea episoadelor dureroase în angina pectorală fiind remarcabilă. În privinţa prognosticului, unele studii observaţionale au arătat scăderea incidenţei anuale a infarctului de 3 ori şi a mortalităţii de 4 ori la pacienţii anginoşi trataţi cu betablocante, pe când altele nu au găsit îmbunătăţirea prognosticului vital.5
Utilizarea betablocantelor în infarctul miocardic e în acord cu fiziopatologia şi este sprijinită de experimentele pe animale care au arătat că, administrate într-un infarct în evoluţie, scad dimensiunea necrozei şi îmbunătăţesc supravieţuirea. Totuşi, utilizarea la om a fost ezitantă, de teama posibilelor efecte adverse: agravarea insuficienţei cardiace, hipotensiune şi bradicardie.
În 1985, Salim Yusuf sintetizează rezultatele a 65 de studii randomizate (50 000 de pacienţi) privind utilizarea betablocantelor în infarctul miocardic. Acest “overview” a folosit un aparat statistic complex pentru a trage concluzii semnificative din studii mai mici şi a fost de fapt prima metaanaliză în cardiologie.6 A analizat separat utilizarea acută a betablocantelor, în primele ore sau zile ale infarctului şi cea cronică, în luni şi ani după externare.
Concluziile primei metaanalize au fost favorabile betablocantelor, dar cu unele nuanţe:
- administrarea acută iv nu aduce beneficiile aşteptate din experimente, aşa că sunt necesare studii noi
- administrarea cronică post-externare, timp de probabil 1 an, reduce mortalitatea cu 25%
- nu există o diferenţă între utilizare diferitelor betablocante, însă cele cu activitate simpatomimetică intensă par a conferi un beneficiu mai mic.
Peste doar 1 an, grupul condus de Yusuf publică rezultatele unui mare studiu care încerca să clarifice dacă administrarea precoce iv a betablocante în infarctul miocardic acut scade mortalitatea. Acest studiu s-a numit ISIS-1 (First International Study of Infarct Survival) şi a cuprins 16 027 pacienţi urmăriţi, în medie, 20 de luni.7 Tratamentul iv s-a administrat la pacienţi fără risc de şoc cardiogen, hipotensiune sau bradicardie, astfel că doar 25-33% din pacienţii cu infarct miocardic acut au fost eligibili.7
Rezultatele studiului au arătat că:
- pacienţii trataţi cu atenolol iv au avut, la 7 zile, o mortalitate cu 15% mai mică decât cei netrataţi
- tratamentul în primele 24 de ore a fost cel mai benefic
- beneficiul s-a păstrat la 1 an, dar a fost nesemnificativ la 20 de luni
Studiul ISIS-2, publicat în 1988, impune în tratamentul infarctului miocardic acut aspirina şi tromboliza. Aşa încât, a apărut necesitatea unei reevaluări a rolului betablocantelor, în condiţiile utilizării de rutină a trombolizei, aspirinei, statinelor şi inhibitorilor de enzimă de conversie. Acest lucru se realizează în 1999, prin metaanaliza lui Freemantle, care ia în calcul 82 de studii randomizate (inclusiv studiul ISIS-1) cu 54 234 pacienţi, mai mult de 50% fiind studii în care s-a aplicat tromboliza.8
Concluziile acestei metaanalize sunt:
- betablocantele administrate pe termen lung post-infarct determină o reducere a mortalităţii de 23%
- administrarea precoce iv a betablocantelor scade riscul aritmic, dar scăderea de mortalitate apare doar dacă este urmată de administrare cronică orală
- chiar în condiţiile tratamentului actual al infarctului miocardic, betablocantele îşi păstrează beneficiul în scăderea mortalităţii. Mai mult, ele reprezintă al doilea cel mai eficient tratament, după reperfuzie.
Această metaanaliză este baza indicaţiei privind tratamentul betablocant de durată post-infarct. În schimb, rămâne neclar beneficiul tratamentului injectabil, existând tabere care susţin sau se opun acestuia, evidenţiate şi prin răspândirea acestui tratament: de exemplu, în anul 2000, se folosea la 54% din cazurile de infarct în Suedia, însă doar la 0,5% în Marea Britanie.9
Pentru clarificarea rolului tratamentului betablocant iv precoce în infarctul miocardic, s-a făcut un studiu gigant în China, COMMIT (ClOpidogrel and Metoprolol in Myocardial Infarction Trial).9 Acest studiu a cuprins 45 852 de pacienţi (dintre care 54% trombolizaţi) cu infarct miocardic acut care au fost trataţi cu metoprolol 5-15 mg administrat iv în primele 12 ore de la debut şi au fost urmăriţi 30 de zile.. Criteriile de excludere au fost: TA<100 mm Hg, AV<50/min, blocul cardiac şi şocul cardiogen. Clasa Killip 2 sau 3 nu a constituit un criteriu de excludere.
Rezultatele au arătat că:
- - tratamentul cu metoprolol iv nu a redus mortalitatea în infarctul miocardic acut, pentru că scăderea cu 18% a reinfarctizării şi cu 17% a fibrilaţiei ventriculare a fost contrabalansată
- de creşterea cu 30% a şocului cardiogen. Şocul cardiogen apare în prima zi, pe când protecţia pentru reinfarctizare şi aritmii apare treptat pe parcursul zilelor următoare
- - tratamentul cu betablocant iv induce mai frecvent şocul cardiogen la anumite categorii de pacienţi: vârstă > 70 ani (risc 2,3%), TA<120 mm Hg (2,3%), AV>110/min (3,5%) şi clasa Killip III (risc 5,7%)
Studiul a fost criticat pentru selecţia defectuoasă, în felul acesta betablocantele fiind administrate la pacienţi instabili hemodinamic, ceea ce dus la incidenţa crescută a şocului cardiogen.10
În 2013, Chatterjee a efectuat o nouă metaanaliză referitoare doar la administrarea precoce iv a betablocantelor în infarctul miocardic acut, în care a luat în calcul 16 studii (inclusiv studiul COMMIT) cu 73 306 pacienţi, dintre care jumătate trombolizaţi.11
Concluziile acestei metaanalize au fost că betablocantele iv, administrate în infarctul miocardic acut, scad mortalitatea intraspitalicească cu 8% (p=0,04), scad aritmiile ventriculare (p=0,0003) şi reinfarctizarea (p=0,004), fără a creşte riscul de şoc cardiogen (p=0,91)
Îndoielile şi, ca urmare, studiile privind administrarea betablocantelor iv nu s-au terminat, pentru că s-a pus în cauză dacă acestea mai au indicaţie în momentul actual când majoritatea pacienţilor sunt reperfuzaţi prin angioplastie primară. Metaanaliza lui Sterling din 2017 cuprinde 4 studii cu un total de 1 149 de pacienţi şi arată că administrarea iv a betablocantelor înainte de angioplastia primară, la pacienţi în clasă Killip 1 sau 2, determină îmbunătăţirea fracţiei de ejecţie la 6 luni cu 2,6%.12
Ultima întrebare fără încă un răspuns privind administrarea betablocantelor în infarctul miocardic este durata administrării post-infarct la pacienţii care nu au disfuncţie de VS (fracţie de ejecţie > 40%). Rezultatele registrelor şi studiilor sunt divergente privind eficienţa şi durata administrării betablocantelor post-infarct la acest tip de pacienţi. Pentru exemplificare, registrul francez de infarct (FAST-MI) studiază 2 679 pacienţi consecutivi cu infarct miocardic acut fără disfuncţie de VS admişi în primele 48 de ore în unitatea coronariană.13 Administrarea betablocantelor a determinat următoarele rezultate:
- mortalitate la 30 de zile mai mică cu 54%, la cei care au primit betablocante în primele 48 de ore
- mortalitate la 1 an mai mică cu 23%, la cei care continuat betablocantele după externare
- mortalitate la 5 ani identică cu cei care nu au primit betablocante, la cei care au continuat betablocantele cel puţin 1 an. Spre comparaţie, cei care au continuat statinele cel puţin 1 an, au avut mortalitatea la 5 ani mai mică cu 58% faţă de cei fără statine.
Datorită acestor incertitudini şi ghidurile de tratament în infarct au indicaţii diferite: în timp ce ghidul american de infarct recomandă ca pacienţii fără disfuncţie de VS să fie trataţi 3 ani, ghidul european afirmă că deocamdată nu se poate face o recomandare privind durata tratamentului betablocant la aceşti pacienţi.14,15 Se speră ca studiul randomizat pe 1 300 pacienţi aflat în desfăşurare (este primul studiu randomizat şi rezultatele sunt aşteptate spre sfârşitul lui 2018) să aducă lumină asupra acestei probleme.
Deşi utilizarea betablocantelor în infarctul miocardic este comună, există reguli care trebuie cunoscute pentru ca tratamentul să fie administrat în momentul oportun, cu medicamentele şi dozele optime şi cu durata adecvată:
- Tratamentul trebuie început cât mai precoce, în primele ore, intravenos sau oral. Beneficiul acut al betablocantelor se păstrează, deşi este mai mic, şi în condiţiile reperfuziei miocardice.
- Dacă există risc de agravare a insuficienţei cardiace, de hipotensiune sau bradicardie, este interzisă administrarea iv, iar administrarea orală se amână 24-48 de ore, până la stabilizare sau clarificare.
- În prezenţa disfuncţiei de VS, administrarea se începe după ce pacientul s-a stabilizat, cu medicamentele indicate în insuficienţa cardiacă (carvedilol, bisoprolol sau metoprolol succinat) şi cu dozele titrate progresiv.
- Continuarea tratamentului după externare este foarte importantă pentru că beneficiile se amplifică în timp, în special la pacienţii cu disfuncţie de VS.
- Durata tratamentului betablocant la pacienţii fără disfuncţie de VS este neclară, dar pare probabil să fie între 6 luni şi 3 ani. Continuarea ulterioară a tratamenului betablocant este posibilă, însă trebuie evaluată periodic pentru a evita polipragmazia inutilă sau o balanţă risc-beneficiu nefavorabilă.
Bibliografie
1. Yusuf S. A 35-year journey to evidence-based medicine: a personal story. Eur Heart J. 2015; 36(48): 3460-6.
2. Ford ES, Ajani UA, Croft JB, et al. Explaining the decrease in U.S. deaths from coronary disease, 1980–2000. N Engl J Med 2007; 356: 2388-98.
3. Black JW. Ahlquist and the development of beta-adrenoceptor antagonists. Postgrad Med J 1976; 52(Suppl 4): 11-3.
4. Keefer CS, Resnik WH. Angina pectoris: a syndrome caused by anoxemia of the myocardium. Arch Int Med 1928; 41: 769-807.
5. Lambert DM. Effect of propranolol on mortality in patients with angina. Postgrad Med J 1976; 52(Suppl 4): 57-60.
6. Yusuf S, Peto R, Lewis J, Collins R, Sleight P. Beta blockade during and after myocardial infarction: an overview of the randomized trials. Prog Cardiovasc Dis. 1985; 27(5): 335-71.
7. ISIS-1 Collaboration. Randomised trial of intravenous atenolol among 16 027 cases of suspected acute myocardial infarction: ISIS-1. First International Study of Infarct Survival Collaborative Group. Lancet. 1986; 2(8498): 57-66.
8. Freemantle N, Cleland J, Young P, Mason J, Harrison J. β Blockade after myocardial infarction: systematic review and meta regression analysis. BMJ. 1999; 318(7200): 1730-7.
9. Chen ZM, Jiang LX, Chen YP, Xie JX, et al. Early intravenous then oral metoprolol in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet. 2005; 366(9497): 1622-32.
10. Waagstein F, Rutherford JD. The evolution of the use of β-Blockers to treat heart failure: a conversation with Finn Waagstein, MD. Circulation. 2017; 136(10): 889-893.
11. Chatterjee S, Chaudhuri D, Vedanthan R, et al. Early intravenous beta-blockers in patients with acute coronary syndrome--a meta-analysis of randomized trials. Int J Cardiol. 2013; 168(2): 915-21.
12. Sterling LH, Filion KB, Atallah R, Reynier P, Eisenberg MJ. Intravenous beta-blockers in ST-segment elevation myocardial infarction: A systematic review and meta-analysis. Int J Cardiol. 2017; 228: 295-302.
13. Puymirat E, Riant E, Aissaoui N, et al. β blockers and mortality after myocardial infarction in patients without heart failure: multicentre prospective cohort study. BMJ. 2016; 354: i4801.
14. O'Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013; 127(4): 529-55.
15. Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018; 39(2): 119-177.

Betablocantele sunt în acest moment una dintre principalele clase de medicamente cu beneficii dovedite în infarctul miocardic acut, având rezultate favorabile în ceea ce priveşte mortalitatea pe termen scurt şi pe termen mediu (1 an).
Administrarea precoce a betablocantelor iv nu este încă o indicaţie de clasă I în ghidurile actuale de tratament al infarctului miocardic, însă se preferă în special la pacienţii fără instabilitate hemodinamică, cu activitate simpatică crescută – tahicardie, TA crescută, în special când se întârzie reperfuzia. În ţara noastră, betablocantele iv au fost folosite doar sporadic.
Betablocantele administrate oral sunt indicate la toţi pacienţii cu infarct miocardic acut: la cei cu disfuncţie sistolică VS pe termen lung, iar la cei fără disfuncţie sistolică de VS pe o perioadă de 1 an.
Dr. Emanuel Stoica, IUBCV “CC Iliescu” Bucureşti
Angiografia prin tomografie computerizată în diagnosticul cardiopatiei ischemice
Autor: Dr. Adrian Mereuţă
IUBCV "CC Iliescu" Bucureşti
Coronarografia este standardul de aur în explorarea circulaţiei coronariene, ea reuşind evidenţierea clară a arterelor cu un diametru > 0,5 mm. În pofida acestei supremaţii, coronarografia are o serie de dezavantaje cum ar fi, pe de o parte, riscurile pe care le implică fiind o procedură invazivă care foloseşte substanţă de contrast şi pe de altă parte, informaţiile care sunt incomplete datorită lipsei vizualizării peretelui vascular. Din acest motiv, s-au căutat alternative neinvazive la coronarografia clasică, cel mai frecvent fiind luate în discuţie angiografia coronariană prin tomografie computerizată şi cea prin rezonanţă magnetică. Însă investigaţiile imagistice neinvazive întâmpină numeroase dificultăţi tehnice (sunt necesare secţiuni multiple, achiziţie rapidă şi prelucrare digitală complexă) în comparaţie cu coronarografia invazivă care are un principiu simplu şi eficace. Cum vizualizarea unor vase de dimensiuni mici (0,5-5 mm) aflate într-o continuă mişcare, cum sunt coronarele, necesită rezoluţii spaţiale şi temporale cât mai mici, superioritatea coronarografiei invazive este evidentă când analizăm datele din tabelul 1.

Odată cu progresul tehnologic, angiografia coronariană efectuată prin tomografie computerizată a reuşit să se apropie de rezoluţiile coronarografiei şi astfel să se detaşeze dintre celelalte investigaţii imagistice ca alternativă la coronarografia clasică, cel puţin pentru screening. Esenţa examinării coronariene prin tomografie computerizată este obţinerea unui set de date cât mai complete asupra fiecărui segment coronarian într-un moment în care segmentul nu se mişcă şi are opacifiere maximă cu contrast.2 Saltul tehnologic a constat în trecerea de la tehnica de tomografie cu fascicul de electroni (EBT) la cea cu detectori multipli. Folosirea detectorilor multipli în tomografia computerizată şi creşterea vitezei de rotaţie a tubului au dus la îmbunătăţirea rezoluţiei spaţiale şi temporale, astfel încât un tomograf cu minim 64 de secţiuni poate efectua o angiografie coronariană (angioCT) de bună calitate. Tomografele cu mai mult de 64 secţiuni (128, 256, respectiv 320 secţiuni), precum şi cele cu 2 surse roentgen aduc un plus la calitatea imaginii, în primul rând prin îmbunătăţirea rezoluţiei spaţiale şi prin eliminarea artefactelor de mişcare (achiziţia se face în 1-3 cicluri cardiace faţă de 4-8 cu tomograful cu 64 de secţiuni), însă precizia rămâne încă departe de cea a coronarografiei deoarece rezoluţia temporală rămâne mult inferioară.3 (Tabelul 1)
Investigaţia se începe cu calcularea scorului de calciu. Un scor de calciu ridicat (>400 U Agatston) indică o probabilitate mare a bolii coronariene, însă şi împiedică estimarea precisă a stenozelor coronariene.4 În schimb, dacă scorul de calciu este zero, probabilitatea de stenoze semnificative este doar de 1,36%, cu un risc anual de evenimente aproape neglijabil (0,3%), astfel încât nici nu mai este necesară efectuarea angiografiei.5 Imediat după scorul de calciu, se face angiografia coronariană propriu-zisă prin injectarea venoasă a 50-100 ml contrast iodat. Calitatea angiografiei depinde în afară de depunerile de calciu, de frecvenţa cardiacă (AV>70/min scade calitatea angiografiei), de regularitatea ritmului cardiac şi de greutatea corporală (IMC>30kg/m2 scade sensibiltatea angioCT şi creşte iradierea pacientului).6
AngioCT permite aprecierea stenozelor coronariene, a peretelui coronarian şi a structurii plăcii aterosclerotice. Mai mult, prin aprecierea vitezei cu care avansează substanţa de contrast în coronare, se poate face o apreciere şi a rezervei funcţionale a circulaţiei coronariene.
AngioCT detectează cu precizie atât plăcile aterosclerotice cu semnificaţie hemodinamică, cât şi cele nesemnificative, având o valoare de predicţie negativă de aproape 100%, în cazurile cu o probabilitate pretest scăzută (<30%).5 În schimb, evaluarea severităţii stenozelor coronariene are o concordaţă mai slabă cu coronarografia clasică (64-87%), mai ales în prezenţa calcificărilor şi la vase < 1,5 mm, angioCT deseori supraestimând severitatea stenozelor.5,7
Angiografia coronariană prin tomografie computerizată este indicată:
- în diagnosticul anginei pectorale stabile la pacienţii cu o probabilitate pretest scăzută. Această indicaţie se bazează tocmai pe valoarea predictivă negativă foarte ridicată. În ghidul european este recomandată ca investigaţie de linia a II-a la pacienţii cu o probabilitate pretest < 50%, pe când în ghidul american este indicată la toţi cei la care testele de stres sunt contraindicate, indiferent de probabilitatea pretest.4,8 Ghidul britanic NICE, în actualizarea din 2016, recomandă o abordare revoluţionară, adică renunţarea completă la evaluarea probabilităţii pretest şi efectuarea angiografiei CT ca primă investigaţie la toţi pacienţii cu angină tipică sau atipică, precum şi la cei asimptomatici, însă cu modificări electrocardiografice sugestive pentru ischemie.9 Acestă atitudine este bazată pe rezultatele unor studii recente, din care cele mai importante sunt PROMISE si SCOT-HEART.10 Pe de altă parte, folosirea angioCT pentru screeningul de rutină la pacienţii asimptomatici cu risc înalt (diabet zaharat) nu a adus un avantaj în reducerea mortalităţii sau a evenimentelor adverse, după cum a arătat studiul FACTOR 64.11
- pentru diagnosticul sindromului coronarian acut la camera de gardă la pacienţii cu troponină negativă. Folosirea angioCT pentru tranşarea diagnosticului de angină instabilă este utilă datorită exactităţii şi rapidităţii metodei. În plus, prin aceeaşi procedură de angioCT se pot exclude şi disecţia de aortă şi tromboembolismul pulmonar. Studiile ROMICAT au arătat că externarea direct din camera de gardă a unui pacient la care angioCT nu a decelat leziuni semnificative este sigură, aceşti pacienţi neprezentând complicaţii cardiace la 30 de zile şi având o incidenţă a complicaţiilor de 4,6% la 2 ani, faţă de 30,3% în cazul celor cu leziuni semnificative.12 În plus, capacitatea angioCT de a vizualiza peretele vascular poate evidenţia anumite aspecte ale plăcii aterosclerotice caracteristice pentru placă instabilă, cum ar fi aspectul în inel pentru şervet („napkin ring”).7
- pentru ghidajul angioplastiei coronariene la pacienţii cu ocluzie coronariană cronică. Tomografia evidenţează gradul de calcificare, tortuozitatea vasului, morfologia bontului, lungimea leziunii, aspecte de care depinde succesul dezobstrucţiei. Totodată evaluarea perfuziei şi a viabilităţii indică şi potenţialul beneficiu al dezobstrucţiei.13
Utilitatea tomografiei computerizate în diagnosticul cardiopatiei ischemice este evidentă şi indicaţiile acesteia sunt în continuă expansiune, însă trebuie avută în vedere şi iradierea implicită. (Tabelul 2) Se estimează că iradierea la tomografie computerizată este responsabilă de 1-2% din cancere în SUA.14 Riscul de cancer este direct proporţional cu iradierea, fiecare mSv aducând un risc de apariţie a cancerului fatal de 1 la 20.000 pe durata vieţii.15 Tinerii şi în special femeile tinere reprezintă categoriile cele mai sensibile la radiaţii: se estimează apariţia cancerului la una din 270 femei de 40 de ani datorită iradierii prin angioCT coronarian.16
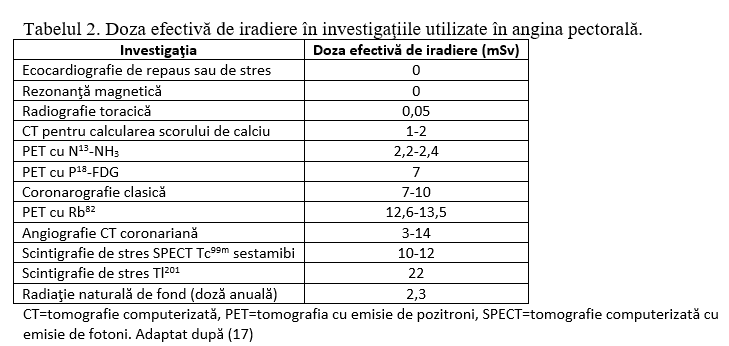
Deoarece iradierea creşte odată cu creşterea numărului de detectori, au fost implementate măsuri pentru reducerea dozei: ghidarea prospectivă a achiziţiei în diastolă (“prospective ECG gating”), achiziţia spirală cu avans rapid (“high pitch”) la tomografele cu 2 surse roentgen, scăderea voltajului tubului la 80-100 kvp la pacienţii normoponderali, bradicardizarea pacienţilor.2,3,16,18-20 Aceste măsuri sunt posibile pentru majoritatea tomografelor în uz, însă decizia utilizării lor depinde de medicul operator, asemănător deciziei de a folosi centura de siguranţă la conducerea autovehiculuui. Doza efectivă de radiaţii recepţionată la un examen CT poate fi calculată din produsul doză-lungime (DLP) prin înmulţirea cu un coeficient de conversie specific fiecărei zone examinate (0,14 pentru torace). În rezultatul oricărui examen CT este specificată DLP, astfel încât prin înmulţirea cu 0,14, se poate calcula doza efectivă de iradiere în fiecare caz.
Pentru optimizarea utilizării angioCT, indicaţia trebuie să ţină seama de o serie de factori care scad calitatea rezultatului sau cresc riscul de iradiere:2
- factori dependenţi de pacient: probabilitate pre-test scăzută sau medie, dar nu la bărbaţi vârstnici, copii sau femei < 40 de ani; absenţa obezităţii, adică un IMC<30kg/m2; ritm cardiac regulat şi bradicardic (ideal < 65/min) sau care să poată fi scăzut prin administrarea de betablocant iv
- factori dependenţi de aparat: tomograf cu minim 64 de secţiuni, care să aibă program de analiză cardiacă şi posibilitatea de reducere a dozei
- factori dependenţi de operator: medic cu experienţă în angioCT care să utilizeze optim protocolul de achiziţie pentru a obţine o calitate bună a imaginii fără a creşte excesiv doza de radiaţii şi care să respecte strict măsurile de reducere a iradierii.
Angiografia coronariană prin tomografie computerizată are indicaţii în continuă expansiune, aşa încât este necesară cunoaşterea principiilor şi limitelor ei. Folosirea ei directă în locul testelor imagistice de evidenţiere a ischemiei este atractivă pentru că scurtează timpul pentru diagnostic şi este mai ieftină, însă trebuie ţinut cont de limitele şi riscurile acesteia, astfel încât decizia să fie luată raţional, în cunoştinţă de cauză.
Bibliografie
1. Lin E, Alessio A. What are the basic concepts of temporal, contrast, and spatial resolution in cardiac CT? J Cardiovasc Comput Tomogr. 2009 ; 3(6): 403–408.
2. Ghekiere O, Salgado R, Buls N, et al. Image quality in coronary CT angiography: challenges and technical solutions. Br J Radiol. 2017; 90(1072): 20160567.
3. Sabarudin A, Sun Z. Coronary CT angiography: Diagnostic value and clinical challenges. World J Cardiol 2013; 5(12): 473-483.
4. Montalescot G, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease. Eur Heart J 2013; 34: 2949–3003.
5. Vrints CJM, Senior R, Crea F, Sechtem U. Assessing suspected angina: requiem for coronary computed tomography angiography or exercise electrocardiogram? Eur Heart J. 2017; 38(23): 1792-1800.
6. Raff GL, Gallagher MJ, O'Neill WW, Goldstein JA. Diagnostic accuracy of noninvasive coronary angiography using 64-slice spiral computed tomography. J Am Coll Cardiol. 2005; 46(3): 552-7.
7. Eckert J, Schmidt M, Magedanz A, Voigtländer T, Schmermund A. Coronary CT angiography in managing atherosclerosis. Int. J. Mol. Sci. 2015; 16: 3740-3756.
8. Fihn SD, Gardin JM, Abrams J, et al. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the diagnosis and management of patients with stable ischemic heart disease. J Am Coll Cardiol 2012; 60: e44 – e164.
9. Moss AJ, Williams MC, Newby DE, Nicol ED. The updated NICE guidelines: cardiac CT as the first-line test for coronary artery disease. Curr Cardiovasc Imaging Rep. 2017;10(5):15.
10. Fordyce CB, Newby DE, Douglas PS. Diagnostic strategies for the evaluation of chest pain: clinical implications from SCOT-HEART and PROMISE. J Am Coll Cardiol. 2016; 67(7): 43-52.
11. Muhlestein JB, Lappé DL, Lima JA, et al. Effect of screening for coronary artery disease using CT angiography on mortality and cardiac events in high-risk patients with diabetes: the FACTOR-64 randomized clinical trial. JAMA. 2014; 312(21): 2234-43.
12. Hollander JE, Than M, Mueller C. State-of-the-art evaluation of emergency department patients presenting with potential acute coronary syndromes. Circulation. 2016; 134(7): 547-64.
13. Opolski MP, Achenbach S. CT angiography for revascularization of CTO: crossing the borders of diagnosis and treatment. JACC Cardiovasc Imaging. 2015; 8(7): 846-58.
14. Brenner DJ, Hall EJ. Computed tomography – an increasing source of radiation exposure. N Engl J Med 2007; 357: 2277–84.
15. Coles DR, Smail MA, Negus IS, et al. Comparison of radiation doses from multislice computed tomography coronary angiography and conventional diagnostic angiography. J Am Coll Cardiol. 2006; 47(9): 1840-5.
16. Sabarudin A, Sun Z, Ng KH. A systematic review of radiation dose associated with different generations of multidetector CT coronary angiography. J Med Imaging Radiat Oncol 2012; 56: 5–17.
17. Einstein AJ, Moser KW, Thompson RC, Cerqueira MD, Henzlova MJ. Radiation dose to patients from cardiac diagnostic imaging. Circulation. 2007;116(11):1290-305.
18. Husmann L, Valenta I, Gaemperli O, et al. Feasibility of low-dose coronary CT angiography: first experience with prospective ECG-gating. Eur Heart J 2008; 29: 191–197.
19. Achenbach S, Marwan M, Schepis T, et al. High-pitch spiral acquisition: a new scan mode for coronary CT angiography. J Cardiovasc Comput Tomogr 2009; 3(2):117-21.
20. Lupescu I. Tomografia computerizată cardiacă, 133-140, în Ginghină C (editor). Mic tratat de cardiologie, ediţia a II-a, Editura Academiei Române, Bucureşti, 2017. ISBN 978-973-27-2828-4
 AngioCT în practica clinică
AngioCT în practica clinică
Angiografia prin tomografie computerizată (angioCT) a devenit una din metodele de investigație de neînlocuit în cardiologia modernă, abilitatea acesteia de a furniza pe cale neinvazivă informații perfect superpozabile cu cele obținute prin coronarografie stând la baza răspândirii ei pe scală largă în ultimii ani. Articolul publicat în acest număr de Dr. Mereuță, pe tema angioCT, realizează o trecere în revistă complexă și actualizată a rolului și indicațiilor acestei noi examinări în boala cardiacă ischemică. Sunt prezentate principalele aplicații ale angiografiei CT, de la diagnosticul sau excluderea prezenței și severității leziunilor coronariene ateromatoase până la aplicații mai complexe cum ar evaluarea neinvazivă a vulnerabilității plăcilor ateromatoase și a semnificației funcțională a acestora. Rolul scorului de calciu, un fidel indicator angioCT al riscului cardiovascular, este evidențiat în articol împreună cu clasele de risc corespunzătoare valorilor acestui scor.
O dată cu progresele tehnologice care au dus la apariția noile scannere CT cu iradiere mai redusă și calitate a imaginii superioară, chiar și în condiții de tahicardie, indicațiile acestei examinări imagistice s-au extins semnificativ, iar articolul de față le descrie într-o manieră foarte concisă și coerentă. Printre aceste indicații se numără și ghidajul angioplastiei coronariene la pacienți cu ocluzie cronică totală, furnizând cardiologului intervenționist informații relevante legate de calea de abordare a ocluziei cronice și detaliile anatomice ale acestora.
În prezent, AngioCT a devenit o tehnică indispensabilă pentru centrele moderne de cardiologie iar informațiile furnizate de AngioCT sunt extrem de utile atât clinicianului pentru diagnosticul prezenței leziunilor ateromatoase coronariene cât și cardiologului intervenționist pentru planificarea intervenției sau medicului de gardă din camera de urgență pentru excluderea celor 3 urgențe cardiovasculare (sindromul coronar acut, sindromul aortic acut și embolia pulmonară) într-o singură examinare. Toate aceste aplicații sunt prezentate într-o manieră complexă în articolul de față, într-o abordare extrem de pragmatică și realistă.
Prof. Dr. Theodora Benedek - Spitalul Clinic Județean de Urgență Tîrgu Mureș
Articolul a redat corect esenţialul în angiografia coronariană prin tomografie computerizată, însă cred că este utilă şi opinia celui care efectuează zilnic această investigaţie, adică a radiologului. Voi evidenţia câteva date tehnice.
Echipamentele CT utilizate pe scară mai largă în examinarea cordului sunt cele cu 64 şi 128 rânduri de detectori, la care rezoluţiile spaţiale şi temporale sunt cele deja menţionate deja în articol, iar timpul de scanare între 6-8 sec în cazul examinărilor dedicate arterelor coronare şi 10-11 sec în cazul evaluarii grafturilor coronariene.
În funcţie de obiectivele examinării şi de alura ventriculară a pacientului se decide modalitatea prospectivă sau retrospectivă de scanare.
Scanarea prospectivă ghidată de EKG presupune scanare de tip secvenţial, limitată la o anumită parte din diastolă. Este modalitatea de examinare cea mai puţin iradiantă, însă necesită un ritm sinusal regulat cu frecvenţă de până la 60-65 bpm şi se adresează exclusiv analizei coronariene.
Scanarea retrospectivă cu gating EKG este spirală, are avantajul achiziţiei extinse pe întregul parcursul ciclului cardiac (cu posibilităţi de modulare a intensităţii curentului pentru reducerea dozei), oferă inclusiv date funcţionale privind cinetica valvelor şi a miocardului, permite reconstrucţii retrospective în oricare dintre fazele ciclului cardiac, însă are dezavantajul unui plus de iradiere.
Echipamentele moderne sunt dotate cu tehnologii de reducere a expunerii la radiaţia ionizantă, ce utilizează algoritmi de reconstrucţie a imaginii pentru reducerea artefactelor cu păstrarea nivelului rezoluţiei în contrast. Din experienţa personală, în cazul unui examen angio-CT coronarian retrospectiv la un pacient normoponderal, doza de iradiere este de 12 mSv -13,5 mSv, deci inferioară unui examen CT de torace şi abdomen sau abdomen şi pelvis.
Scorul de Calciu, prima etapă a angiografiei CT de cord, este o modalitate acceptată ca factor predictiv şi de stratificare a riscului de eveniment coronarian acut şi se realizează printr-o scanare secvenţiala prospectivă, low –dose cu secţiuni având grosime de 3 mm. La pacienţii examinaţi în serviciul nostru, doza de iradiere este de 2-3 mSv.
Un test negativ- scor de calciu zero înseamnă că prezenţa plăcii aterosclerotice, inclusiv a celei instabile/vulnerabile, este improbabilă şi echivalează cu un risc redus (0,1%) de eveniment cardiovascular în următorii 2-5 ani.
Valori ale scorului de calciu de peste 400 unităţi Agatston (UA) reduc sensibilitatea cuantificării corecte a stenozei coronariene, de obicei prin supraestimare a stenozei, în timp ce valori de 7-800 UA, contraindică, în principiu, examinarea prin riscul clasificarii incorecte a stenozei. Personal, am acceptat pacienţi cu scor calciu până la 8-900 UA -cooperanţi, în ritm sinusal regulat < 65 bpm şi normoponderali, la care am putut exclude stenoza coronariană semnificativă, însă posibilitatea de a realiza o examinare corectă trebuie apreciată individual, în funcţie de caz.
Este recunoscut faptul că avantajul major al coronarografiei CT constă în posibilitatea evidenţierii şi caracterizării plăcilor “moi”, fibrolipidice şi a impactului acestora asupra lumenului vascular. O achiziţie optimă a imaginilor permite, prin reconstrucţii complexe, o apreciere obiectivă a stenozei aterosclerotice necalcificate, chiar atunci când este excentrică. Placa vulnerabilă, cu conţinut lipidic bogat şi capişon subţire, precum şi remodelarea pozitivă- aspecte ale aterosclerozei cu prevalenţă crescută în sindromul coronarian acut, pot fi evaluate neinvaziv doar prin examen angio-CT. De remarcat că, datorita progreselor tehnologice în postprocesarea imaginii, aceste analize ale plăcilor aterosclerotice şi estimarea gradului de stenoză coronariană, se fac rapid, fără consum excesiv de timp.
Alte două indicaţii ale angio-CT nesuplinite de o altă examinare imagistică noninvazivă sunt legate de evaluarea anatomiei venelor pulmonare premergator tratamentului de ablaţie prin radiofrecvenţă pentru fibrilaţia atrială şi mapping-ul sistemului venos coronarian la pacienţii referiţi terapiei de resincronizare.
Concomitent cu obţinerea de informaţii privind arterele coronare, examenul angio-CT permite şi aprecieri ale morfologiei cordului, evidenţierea incidentală a maselor cardiace sau a trombilor din cavitaţilor cordului, a anevrismelor septale, atriale sau ventriculare, afecţiuni ale pericardului.
În concluzie, coronarografia CT este o metodă robustă de evaluare a arterelor coronare, iar scorul de calciu reprezinta o modalitate simplă, rapidă şi puţin iradiantă de stratificare a riscului de boală coronariană.
Dr. Ofelia Niţă, medic primar radiologie- imagistică medicală, Clinica MedLife, Bucureşti
Tratamentului antiagregant plachetar perioperator la pacienţii cu stent
Autor: Dr. Adrian Mereuţă
IUBCV "CC Iliescu" Bucureşti
Pacienţii cu angioplastie cu stent efectuează în 4-9% din cazuri intervenţii chirurgicale necardiace în primul an, iar la 12% din aceştia, intervenţia se efectuează în primele 6 săptămâni.1-3 Chirurgia induce hipercoagulabilitate în primele 7 zile, iar oprirea tratamentului antiplachetar accentuează această stare protrombotică, astfel încât riscul de tromboză de stent este crescut, atât timp cât endotelizarea stentului nu este completă. Tromboza de stent este o complicaţie redutabilă ce determină infarct miocardic în 70% din cazuri şi deces în 20%, în funcţie de locul în care este stentul plasat.4 Pe de altă parte, riscul hemoragic este crescut cu 50% de aspirină, iar asocierea aspirină şi clopidogrel amplifică riscul de 3,4 ori faţă de tratamentul cu aspirină.5,6
Conduita tratamentului antiplachetar în perioada perioperatorie este încă neclară, însă atât recentul ghid ESC privind terapia dublă antiplachetară (DAPT), cât şi o serie de studii apărute în ultima perioadă aduc elemente utile în această direcţie. În esenţă, pentru decizia chirurgiei şi a DAPT, trebuie avute în vedere 3 elemente:
- riscul de tromboză de stent dacă se întrerupe DAPT
- consecinţele amânării intervenţiei chirurgicale
- riscul de sângerare periprocedurală şi consecinţele acesteia.7
O serie de studii recente aduc date importante referitoare la riscul trombotic. Două studii de registru, unul american pe 28 173 pacienţi şi unul danez pe 24 535 pacienţi cu angioplastie cu stent activ (DES), arată că pacienţii cu intervenţii chirurgicale efectuate la 12-24 luni de la implantarea unui stent au un risc crescut de infarct miocardic perioperator.8,9 Acest risc este maxim în primele 4-6 săptămâni după implantarea de stent, ulterior reducându-se semnificativ.8-10 Este remarcabil că, după primele 6 saptămâni, nu există diferenţă în incidenţa complicaţiilor majore (MACE) între stenturile metalice simple (BMS) şi cele active (DES).11 Totuşi alte studii arată că intervenţia chirurgicală este sigură doar după 6 luni de la implantarea de DES.12
Pe baza ultimelor studii, ghidul ESC privind DAPT recomandă un interval minim de 1 lună după implantare de stent pentru chirurgia electivă, indiferent de tipul de stent, cu oprirea inhibitorului de P2Y12 cu 3-7 zile înainte de intervenţie (ticagrelor 3 zile, clopidogrel 5 zile, prasugrel 7 zile).7 Modificările faţă de ghidul ESC de chirurgie necardiacă din 2014 sunt reducerea intervalului la DES de la 6 luni la o lună ca şi la BMS şi scurtarea intervalului de oprire a ticagrelorului la 3 zile.13 Pentru pacienţii cu sindrom coronarian acut sau alte condiţii cu risc trombotic crescut, intervenţia chirurgicală electivă se recomandă după 6 luni de la angioplastia cu stent, la fel ca în ghidul precedent.
Pe de altă parte, există intervenţii la care riscul hemoragic este mic sau hemoragia poate fi uşor controlată la care nu se recomandă oprirea DAP şi altă categorie de intervenţii la care consecinţele hemoragiei sunt devastatoare şi la care se recomandă oprirea preoperatorie nu numai a inhibitorului P2Y12, ci şi a aspirinei.
După ghidul interdisciplinar (cardiologi, chirurgi, anestezişti) italian din 2014, intervenţiile chirurgicale pot fi clasificate după riscul hemoragic în felul următor:12
A. risc hemoragic mic:
- chirurgie generală: hernie, apendicectomie, colecistectomie, rezecţie gastrică, rezecţie intestinală sau colică, chirurgia sânului
- chirurgie vasculară: endarterectomie carotidiană, bypass sau endarterectomie la nivelul membrelor inferioare, cura endovasculară a anevrismelor de aortă
- ortopedie: chirugia mâinii, intervenţii artroscopice la genunchi sau umăr, chirugie spinală minoră
- urologie: cistoscopie cu cistoscop flexibil, ureteroscopie, sondaj ureteral
- chirurgie toracică: toracoscopie diagnostică, rezecţie de perete toracic, segmentectomie pulmonară
- endoscopie digestivă: endoscopie superioară sau inferioară ± biopsie, ecoendoscopie fără biopsie, polipectomie de polipi mici (<1cm), ERCP, stent, dilatare de papilă fără sfincterotomie
B. Risc hemoragic mediu:
- chirurgie cardiacă: minitoracotomie, TAVI cu abord apical, bypass aortocoronarian, înlocuire valvulară
- chirurgie generală: cura hemoroizilor, splenectomie, gastrectomie, chirurgie bariatrică, tiroidectomie
- chirurgie vasculară: chirurgia aortei abdominale
- ortopedie: protezare de umăr, chirurgie spinală majoră, chirurgia genunchiului, chirurgia piciorului
- urologie: biopsia de prostată, orchiectomie, circumcizie
- chirurgie toracică: lobectomie, pneumectomie, mediastinoscopie, sternotomie, rezecţia de tumori mediastinale
- endoscopie digestivă: endoscopie cu biopsie de aspiraţie (fine needle biopsy) de tumori solide, dilatare de stenoze esofagiene sau colorectale, stenturi gastrointestinale, coagulare cu plasmă de argon, polipectomie pentru polipi > 1 cm, gastrostomie percutanată, scleroză sau bandare de varice esofagiene, scleroză sau bandare de hemoroizi
C. Risc hemoragic crescut:
- chirurgie cardiacă: reintervenţii, endocardite, bypass aortocoronarian de salvare după o complicaţie a angioplastiei, disecţia de aortă
- chirurgie generală: rezecţie hepatică, duodenocefalopancreatectomie
- chirurgie vasculară: intervenţii toracice sau toracoabdominale
- ortopedie: protezare majoră de şold sau genunchi, traumatologie majoră (pelvis, oase lungi), fracturi femurale la vârstnici
- urologie: nefrectomie radicală sau parţială, nefrostomie percutanată, litotriţie percutanată, cistectomie şi prostectomie radicală, TURP, TURBT, penectomie, orhiectomie parţială
- chirurgie toracică: esofagectomie, pleuropneumectomie, decorticare pulmonară
- endoscopie digestivă: rezecţie de mucoasă sau submucoasă, ecografie cu biopsie (fine needle biopsy) de chisturi pancreatice, ampulectomie a ampulei Vater, dilataţie în acalazie
Toate aceste informaţii sunt utile pentru a lua decizia optimă în privinţa momentului intervenţiei chirurgicale şi a conduitei terapeutice la fiecare pacient:7,12
- O intervenţie chirurgicală electivă trebuie amânată cel puţin 3 luni la un pacient cu implantare de stent, respectiv 6 luni dacă este vorba de un sindrom coronarian acut, pentru ca întreruperea DAPT să fie cât mai puţin riscantă;
- Dacă acest lucru nu se poate, se recomandă amânarea intervenţiei măcar 4-6 săptămâni şi efectuarea ei într-un spital care are şi posibilitate de angioplastie coronariană. DAPT va fi reluată la 1-3 zile după operaţie, cu doză de încărcare;
- Intervenţiile de urgenţă care se fac în mai puţin de o lună de la implantarea de stent se fac cu asumarea unui risc hemoragic important pe dublă terapie antiplachetară; riscul hemoragic poate fi scăzut dacă inhibitorul de receptor P2Y12 se opreşte cu 5 zile înainte pentru clopidogrel, respectiv 3 zile înainte pentru ticagrelor şi se administrează un inhibitor IIb/IIIa ca punte;
- Intervenţiile cu risc mic de sângerare, cu excepţia celor din chirurgia toracică, se pot efectua fără a opri terapia dublă antiplachetară. Acest lucru este valabil şi pentru toate intervenţiile stomatologice, pentru că sângerările pot fi controlate prin terapie locală.14
- Intervenţiile cu risc mediu sau mare de sângerare se fac cu întreruperea inhibitorului P2Y12, cu excepţia celor din chirurgia vasculară la care acesta nu se întrerupe. Administrarea ca punte a unui inhibitor IIb/IIIa se face în cazurile cu risc trombotic mare, însă judecata se face de la caz la caz.
- De regulă aspirina se continuă perioperator, beneficiul ei depăşind riscul de săngerare suplimentar. Totuşi, atunci când consecinţele sângerării sunt foarte severe sau riscul de sângerare este foarte mare, se recomandă şi întreruperea aspirinei: în intervenţiile intracraniene, intraoculare, prostatectomie transuretrală sau în orice intervenţie la un pacient cu risc de sângerare extrem de ridicat.15
Intervenţiile chirurgicale efectuate după angioplastia cu stent sunt riscante, dar ele sunt deseori necesare. Deşi există multe necunoscute, cunoaşterea riscului trombotic, respectiv hemoragic, permit ajustarea terapiei antiplachetare astfel încât riscurile chirurgiei să fie micşorate. Din fericire, calităţile stenturilor active de ultimă generaţie au făcut ca durata terapiei antiplachetare duble să nu se mai judece în funcţie de stent, ci de condiţia clinică. Totuşi conduita terapeutică nu va stabilită pe date generale, ci se va adapta de la caz la caz.
Bibliografie
1. Berger PB, Kleiman NS, Pencina MJ, et al. Frequency of major noncardiac surgery and subsequent adverse events in the year after drug-eluting stent placement results from the EVENT (Evaluation of Drug-Eluting Stents and Ischemic Events) Registry. JACC Cardiovasc Interv. 2010; 3: 920–7.
2. Hawn MT, Graham LA, Richman JR, et al. The incidence and timing of noncardiac surgery after cardiac stent implantation. J Am Coll Surg. 2012;214:658–66.
3. Gurajala I, Gopinath R. Perioperative management of patient with intracoronary stent presenting for noncardiac surgery. Ann Card Anaesth. 2016 ; 19(1): 122–131.
4. Ong AT, McFadden EP, Regar E, de Jaegere PP, van Domburg RT, Serruys PW. Late angiographic stent thrombosis (LAST) events with drug-eluting stents. J Am Coll Cardiol. 2005;45:2088–92.
5. Payne DA, Hayes PD, Jones CI, Belham P, Naylor AR, Goodall AH. Combined therapy with clopidogrel and aspirin significantly increases the bleeding time through a synergistic antiplatelet action. J Vasc Surg. 2002;35:1204-9.
6. Burger W, Chemnitius JM, Kneissl GD, Rücker G. Low-dose aspirin for secondary cardiovascular prevention, cardiovascular risks after its perioperative withdrawal versus bleeding risks with its continuation - review and meta-analysis. J Intern Med. 2005;257:399-414.
7. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Heart J 2017; 0: 1-48.
8. Holcomb CN, Graham LA, Richman JS, Itani KM, Maddox TM, Hawn MT. The incremental risk of coronary stents on postoperative adverse events: a matched cohort study. Ann Surg 2016;263:924–930.
9. Egholm G, Kristensen SD, Thim T, et al. Risk associated with surgery within 12 months after coronary drug-eluting stent implantation. J Am Coll Cardiol 2016;68:2622–2632.
10. Cruden NL, Harding SA, Flapan AD, et al; Scottish Coronary Revascularisation Register Steering Committee. Previous coronary stent implantation and cardiac events in patients undergoing noncardiac surgery. Circ Cardiovasc Interv. 2010;3:236-42.
11. Wijeysundera DN,Wijeysundera HC, Yun L, et al. Risk of elective major noncardiac surgery after coronary stent insertion: a population-based study. Circulation 2012; 126: 1355–62
12. Rossini R, Musumeci G, Visconti LO, et al. Perioperative management of antiplatelet therapy in patients with coronary stents undergoing cardiac and non-cardiac surgery: a consensus document from Italian cardiological, surgical and anaesthesiological societies. EuroIntervention 2014;10:38–46.
13. Kristensen SD, Knuuti J, Saraste A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J. 2014 ;35(35): 2383-431.
14. Napeñas JJ, Oost FC, DeGroot A, Loven B, Hong CH, Brennan MT, et al. Review of postoperative bleeding risk in dental patients on antiplatelet therapy. Oral Surg Oral Med Oral Pathol Oral Radiol. 2013;115(4):491-9.
15. Ferraris VA, Saha SP, Oestreich JH, et al, Society of Thoracic Surgeons. 2012 update to the Society of Thoracic Surgeons guideline on use of antiplatelet drugs in patients having cardiac and noncardiac operations. Ann Thorac Surg 2012;94:1761–1781.
Medicaţia antitrombotică la pacienţii cu insuficienţă renală cronică
Autor: Dr. Adrian Bucşa
IUBCV "CC Iliescu" Bucureşti
Insuficienţa renală cronică (IRC) se caracterizează printr-o combinaţie stranie de predispoziţie la sângerări şi status protrombotic. Fiziopatologia complexă a acestei situaţii nu poate fi rezumată nici măcar pe scurt, dar pot fi amintite disfuncţia plachetară, formarea crescută de prostaglandină I2 şi alterarea factorului von Willebrand, implicate, printre altele, în predispoziţia la sângerări, iar pe de altă parte, creşterea activatorului de plasminogen (PAI-1), modificări ale metabolismului proteinelor C şi S, şi altele, responsabile de condiţia protrombotică.
Există numeroase ghiduri cu privire la folosirea medicaţiei antitrombotice în populaţia generală, dar studiile majore pe care se bazează aceste ghiduri nu includ, de regulă, pacienţii cu insuficienţă renală, cu atât mai puţin pe cei aflaţi în stadiile avansate (end-stage renal disease, ESRD). Iata de ce utilizarea acestor medicamente la pacienţii renali pune uneori probleme reale şi, în acest caz, opinia experţilor e foarte importantă. În cele ce urmează, vom încerca să arătăm pe scurt care din numeroasele medicamente antitrombotice pe care le avem la dispoziţie pot fi folosite în insuficienţa renală cronică, în funcţie de stadiul acesteia. Vom discuta, pe rând, medicaţia antiagregantă, apoi medicaţia anticoagulantă, fiecare cu subgrupele orală şi injectabilă.
Stadializarea IRC se face în funcţie de valoarea ratei filtrării glomerulare (RFG, măsurată în ml/min/1.73 m²), iar clasificarea KDOQI (Kidney Disease Outcomes Quality Initiative) este următoarea: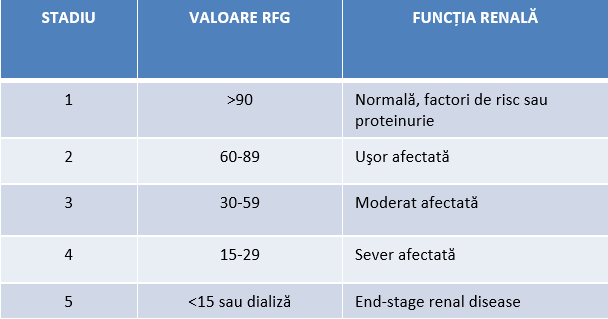
I. Antiagregantele plachetare orale
Aspirina poate fi folosită fără probleme în stadiile 1-3 ale IRC, fără ajustari ale dozei. În stadiile 4 şi 5, se recomandă utilizarea doar în prevenţia secundară şi limitarea dozei la 100 mg/zi, pentru a evita potenţiala deteriorare a funcţiei renale.
Clopidogrelul se foloseşte cu doza de încărcare de 600 mg în toate stadiile, cu excepţia bolnavilor dializaţi, la care se face încărcare cu 300 mg; dacă este vorba de o intervenţie coronariană pentru STEMI, atunci şi la aceşti bolnavi doza este de 600 mg. În stadiile 1-3, doza de întreţinere este cea uzuală, de 75 mg pe zi. Nici în stadiile 4 şi 5 nu se reduce doza, însă nu se recomandă ca monoterapie în loc de aspirină, ci doar în asociere cu aceasta după montarea unor stenturi (coronariene sau periferice).
Prasugrelul se administrează în doză de încărcare de 60 mg în stadiile 1-3. În stadiile 4-5, se poate folosi doar în caz de intervenţie percutană urgentă pentru STEMI. Doza de întreţinere este de 10 mg pe zi (5 mg dacă pacientul cântăreşte sub 60 kg ). O analiză post-hoc a unui grup de pacienţi cu IRC stadiul 3-4 (pre-ESRD) în cadrul studiului TRITON-TIMI 38 sugerează că, la aceşti pacienţi, clopidogrelul e mai eficient şi mai sigur decât prasugrelul.
Ticagrelorul se foloseşte cu aceeaşi doză de încărcare de 180 mg la toţi pacienţii în stadiile 1-3, doza de întreţinere fiind de 90 mg de două ori pe zi. În stadiul 4, medicamentul pare sigur şi eficient, o analiză post-hoc a unui subgrup de pacienţi cu IRC din studiul PLATO arătând că ticagrelorul e mai eficient decât clopidogrelul la aceşti pacienţi. Nu se recomandă folosirea în stadiul 5 din cauza datelor insuficiente.
II. Antiagregantele plachetare injectabile
În ceea ce priveşte inhibitorii de glicoproteină IIb/IIIa, astăzi mai putin folosiţi, abciximab se poate folosi în stadiile 1-3 fără reducerea dozei, dar în stadiile 4 şi 5, administrarea trebuie făcută cu precauţie din cauza riscului de sângerare. La tirofiban şi eptifibatidă se reduc dozele cu 50% în stadiile 3 şi 4, utilizarea lor în stadiul 5 fiind contraindicată.
III. Anticoagulantele injectabile
Heparina nefracţionată este metabolizată în ficat şi în endoteliu aşa încât teoretic nu este necesară reducerea dozelor nici măcar în stadiile 4 şi 5. Totuşi, dozele recomandate sunt mai mici la pacienţii cu IRC avansată din cauză că, odată ce se saturează sistemul reticuloendotelial care metabolizează heparina, restul de substanţă necesita eliminare pe cale renala, existând astfel riscul de supradozaj.
Heparinele cu greutate moleculară mică (HGMM) sunt eliminate predominant renal aşa încât este necesară reducerea dozelor. Ca regulă generală, la un clearance al creatininei peste 40 ml/min nu se reduc dozele, între 30 şi 39 se administează 80-90% din doza clasică, o dată pe zi, iar la o valoare sub 30 se administrează 60% din doză, împărţită în două prize la 12 ore sau se trece pe heparină nefracţionată. Se recomandă monitorizarea activităţii anti-Xa în tratamentul cu HGMM la un clearance sub 50 ml/min.
Enoxaparina este aprobată pentru tratamentul sindroamelor coronariene acute şi al tromboembolismului pulmonar la pacienţii renali cu clearance al creatininei sub 30 ml/min/1,73m², doza fiind de 1mg/kc/zi, aşadar jumătate din cea obişnuită. Totuşi, utilizarea acestei doze duce la un sfert dintre pacienţi la un nivel de activitate anti-Xa insuficient (< 0.5 UI/ml), aşa încât este preferabilă monitorizarea activităţii anti-Xa şi ajustarea dozelor în funcţie de aceasta. Experienţa cu dalteparina şi tinzaparina este limitată la pacienţii cu IRC severă.
Fondaparinux este contraindicat în stadiile 4 si 5, în rest se poate administra în dozele uzuale.
Bivalirudina este eliminată prin rinichi, dar şi prin clivaj enzimatic. Doza se reduce în stadiile 4 şi 5 de la 1,75 la 1,0 sau chiar 0,25 mg/kc/min.
IV. Anticoagulantele orale
Antivitaminele K (AVK) – acenocumarol, warfarina sau fenprocumon, sunt încă cel mai frecvent folosite anticoagulante orale, atât la pacienţii cu funcţie renală normală cât şi la cei cu IRC, deşi în anii următori e de aşteptat să asistăm la schimbări. Din numeroasele probleme legate de folosirea AVK la pacienţii cu IRC sintetizăm câteva:
- Este necesară reducerea dozelor, deşi eliminarea este predominant hepatică. Astfel, pentru un clearance al creatininei între 30 şi 60 ml/min este necesară reducerea în medie a dozelor cu 10%, iar pentru o valoare sub 30 ml/min este necesară reducerea dozelor cu 20%.
- Pacienţii cu IRC au un risc mai mare de a avea supradozaj (INR>4.0), fiind astfel la un risc hemoragic mai mare.
- Calcificările vasculare produse prin hiperfosfatemie în IRC sunt în mod normal inhibate de proteina matriceală G1a, care însa necesită pentru acţiune vitamina K. Cum însă AVK au tocmai acest mecanism de acţiune, se poate ca utilizarea lor prelungită să ducă la accentuarea calcificărilor vasculare.
- Nefropatia indusă de warfarină reprezintă o creştere neexplicată a creatininei serice cu ≥ 0.3 mg/ml la cca o săptămână de la atingerea unui INR ≥ 3.0. O treime din pacienţii cu IRC care iau warfarină dezvoltă această complicaţie, care are o mortalitate la un an de 19-31%. Acesta este şi unul din motivele pentru care, în orice stadiu al IRC, dozele trebuie ajustate pentru a menţine valoarea INR între 2.0 si 3.0
Noile anticoagulante orale, care au ca mecanism de acţiune fie inhibiţia directă a trombinei (dabigatran), fie a factorului Xa (celelalte), se elimină renal în procente diferite, între 27% pentru apixaban şi 85% pentru dabigatran.
Dabigatran are nevoie de o reducere a dozei începând cu stadiul 4 până la 75 mg de două ori pe zi, conform FDA, şi maxim 110 mg de două ori pe zi, în cazuri selectate, conform EMEA. Nu se recomandă folosirea în stadiul 5.
Rivaroxaban se foloseşte la doza obişnuită de 20 mg o dată pe zi în stadiile 1 şi 2, 15 mg o dată pe zi în stadiul 3 şi, rareori, în stadiul 4. În stadiul 5 administrarea este contraindicată la pacienţii care nu fac dializă, din cauza riscului de acumulare, în schimb poate fi folosit, cu precauţie extremă, la pacienţii dializaţi, monitorizând activitatea anti-Xa.
Apixaban se foloseşte la dozele uzuale de 2,5 sau 5 mg de două ori pe zi în stadiile 1-3. Nu se utilizează în stadiul 4 şi nici în stadiul 5 la pacienţii care nu fac dializă, în schimb se poate încerca doza de 2,5 mg de două ori pe zi la dializaţi, monitorizând activitatea anti-Xa.
Edoxaban se foloseşte în doză uzuală de 60 mg o dată pe zi în stadiile 1 şi 2, respectiv 30 mg o dată pe zi în stadiile 3 şi 4. Este contraindicat în stadiul 5, indiferent dacă pacientul face dializă sau nu.
Bibliografie
1. Capodanno D., Angiolillo DJ. Antithrombotic therapy in patients with chronic kidney disease. Circulation. 2012; 125: 2649-2661.
2. Witt CT, Healey JS. Oral anticoagulant use in patients with chronic kidney disease: how to choose, and the importance of empiric human data. Can J Cardiol 2014; 30: 853-854.
3. Lutz J, Jurk K, Schinzel H. Direct oral anticoagulants in patients with chronic kidney disease: patient selection and special considerations. Int J Nephrol Renovasc Dis 2017; 10: 135-143.
4. Chunduri S, Folstad JE. Antithrombotic therapy in end-stage renal disease. Hemodial Int. May 23 2017; doi:10.1111/hdi.12571
5. National Kidney foundation K/DOQI Clinical practice guidelines for chronic kidney disease: evaluation, classification and stratification. Am J Kidney Dis 2002; 39 (Suppl 1): S1-S266.

Insuficienţa renală cronică (IRC) deseori acompaniază bolile cardiovasculare, în special la pacienţii vâstnici, complicând evoluţia şi tratamentul acestora. Tratamentul antitrombotic este în mod particular dificil la un pacient cu IRC, datorită riscului hemoragic. Pacientul cu fibrilaţie atrială şi IRC fără tratament anticoagulant are un risc trombotic crescut (de 5,5 ori mai mare pentru un scor CHA₂DS₂-VASc = 0 şi de 1,6 ori mai mare pentru un scor CHA₂DS₂-VASc ≥ 2, după un registru danez pe 12 856 pacienţi), însă la acelaşi pacient tratamentul antitrombotic determină un risc hemoragic mai mare decât la un pacient fără IRC. Pacienţii cu IRC în stadiul 5 ridică cele mai dificile probleme, pentru că cele mai multe studii arată că, cel puţin în fibrilaţia atrială, tratamentul anticoagulant este puţin eficient în scăderea riscului trombotic, dar creşte semnificativ riscul hemoragic.
Dr. Adrian Bucşa a tratat clinic şi intervenţional un număr semnificativ de pacienţi cu insuficienţă renală şi s-a lovit deseori de problemele conducerii unui tratament antitrombotic la aceşti pacienţi. Articolul de faţă este o valoroasă aducere la zi a tratamentului antitrombotic la pacienţii cu insuficienţă renală. O notă aparte în privinţa noilor anticoagulante orale, la care datele sunt încă o ţintă în mişcare, noile studii putând schimba indicaţiile din ghiduri în timp ce acesta sunt scrise.
În concluzie:
- Deşi inhibă vasodilataţia renală indusă de prostaglandine, aspirina în doză ≤ 100 mg/zi poate fi utilizată în profilaxia secundară la pacienţii cu IRC.
- Inhibitorii receptorului P2Y12 nu necesită reducerea dozei în IRC, totuşi clopidogrelul este preferabil datorită riscului mai mic de sângerare.
- Heparina nefracţionată este anticoagulantul parenteral preferabil la pacienţii cu RFG < 50 ml/min.
- Anticoagulantele orale clasice sunt preferate noilor anticoagulante orale pentru insuficienţa renală cu RFG < 30 m/min.
- La pacienţii cu IRC în stadiul 5, tratamentul anticoagulant se indică doar când riscul hemoragic este foarte ridicat (proteză valvulară metalică, cardioembolie în antecedente).
Dr. Adrian Mereuţă, IUBCV „CC Iliescu” Bucureşti
Infarctul miocardic indus de cocaină
Autor: Dr. Adrian Mereuţă
IUBCV "CC Iliescu" Bucureşti
Cocaina este un alcaloid extras din planta Erythroxylum coca, originară din America de Sud. Frunzele acestei plante sunt folosite de peste 5000 de ani de indigenii din America de Sud pentru efectul curativ şi stimulativ, însă în Europa şi SUA este utilizată abia din secolul XIX ca anestezic local. Utilizarea ei alimentară (inclusiv în reţeta originală de Coca-Cola) a fost interzisă de guvernul american în 1914, atunci când s-a constatat că dă dependenţă şi are numeroase efecte adverse, în special cardiovasculare. Începând cu 1960, utilizarea cocainei, de data asta ca drog ilegal, a crescut vertiginos, în primul rând în Statele Unite, astfel încât se apreciază că, în SUA, 14% din populaţia de peste 12 ani, adică 34 milioane de oameni, a încercat cocaina cel puţin o dată în viaţă, iar 6 milioane o utilizează curent. Acuzele cardiovasculare legate de consumul de cocaină determină 5-10% din toate prezentările la camera de gardă, adică aproximativ 500 000 pe an.1,2 În Europa, consumul este mai mic de jumătate faţă de SUA, însă s-a dublat în ultimii 10 ani.3 Consumul variază semnificativ între diferite ţări, 66% din totalitatea consumului european fiind înregistrat în Marea Britanie, Spania şi Italia; din fericire, România este pe ultimul loc în Uniunea Europeană la consumul de cocaină.3 Consumul de droguri ilegale a crescut rapid după 1990 şi în ţara noastră, dar în general sunt preferate druguri uşoare care sunt mai ieftine şi mai uşor de găsit (etnobotanice, canabis).4 Cocaina se situează pe locul 4 între drogurile ilicite consumate în România, fiind încercată de 0,8% din populaţia cu vârstă 15-64 de ani, dar consumată în ultimul an de 0,2% din aceeaşi populaţie.4 Deşi cazurile de infarct miocardic indus de cocaină sunt deocamdată rare în ţara noastră, considerăm că este utilă cunoaşterea trăsăturilor lor caracteristice.
Acţiunea principală a cocainei este inhibarea recaptării serotoninei şi dopaminei la nivel cerebral şi a noradrenalinei şi dopaminei la nivelul ganglionilor simpatici; în plus stimulează secreţia de adrenalină la nivel suprarenal. Rezultatul este creşterea puternică a excitaţiei simpatice atât la nivel central, cât şi la nivel periferic.5 Cocaina creşte frecvenţa cardiacă şi tensiunea arterială proporţional cu doza. Utilizarea cronică duce la hipertensiune, degenerescenţă miocitară progresivă şi ateroscleroză precoce.6,7 Cocaina are şi efect anestezic prin inhibarea canalelor de sodiu în timpul depolarizării.
Cocaina induce ischemie şi infarct miocardic prin cumularea mai multor mecanisme:
- creşte consumul de oxigen prin creşterea frecvenţei cardiace, a tensiunii arteriale şi a contractilităţii miocardice;
- descreşte aportul de oxigen prin vasoconstricţie coronariană ;
- induce o stare protrombotică prin stimularea agregării plachetare;
- determină ateroscleroză accelerată (la consumul cronic).1
Vasoconstricţia este mecanismul caracteristic cocainei şi este mai severă în combinaţie cu ateroscleroza preexistentă sau fumatul. Vasoconstricţia se produce atât prin potenţarea efectelor simpatomimetice, cât şi printr-o creştere directă a influxului intracelular de Ca++ prin intermediul interacţiunii cocainei cu receptorii de angiotensină II, de histamină H2 sau cu canalul L de Ca++.5,8 Vasoconstricţia rareori poate ajunge până la ocluzia completă a vasului, în absenţa trombozei sau rupturii de placă aterosclerotică.9
Diagnosticul infarctului indus de cocaină
Infarctul indus de cocaină apare tipic la pacienţi tineri, fumători, cu puţini factori de risc, care se prezintă la camera de gardă cu durere toracică la câteva ore după consumul de cocaină.10,11 Infarctul miocardic se poate datora consumului cronic, dar poate apărea şi la consumul sporadic sau chiar la utilizarea cocainei drept anestezic local în ORL.11 Durerea toracică este motivul principal pentru se prezintă la camera de gardă consumatorii de cocaină. Alte simptome frecvente sunt dispneea, anxietatea, diaforeza, palpitaţiile, ameţeala şi greaţa.1 Durerea este deseori ascuţită, cu caracter de înţepătura, poate fi de tip pleuritic sau poate fi sub formă de presiune.10 De cele mai multe ori durerea nu este ischemică, însă la 0,7-6% din pacienţi poate semnaliza infarct miocardic acut; în plus, trebuie excluse disecţia de aortă şi hipertensiunea pulmonară, afecţiuni favorizate de cocaină.
În esenţă, în diagnosticul infarctului indus de cocaină există două situaţii:
- de a identifica care dintre pacienţii consumatori de cocaină ce se prezintă cu durere toracică au infarct miocardic
- de a identifica la care dintre pacienţii cu infarct miocardic acesta se datorează consumului de cocaină
Electrocardiograma este utilă în diagnosticul infarctului miocardic acut, însă mai puţin decât în cazurile clasice, în condiţiile în care 61% din infarctele induse de cocaină sunt fără supradenivelare de segment ST, iar majoritatea pacienţilor cu durere după consumul de cocaină au electrocardiograma modificată, indiferent dacă au ischemie miocardică sau nu (repolarizare precoce, hipertrofie ventriculară stângă, modificări nespecifice de segment ST şi undă T).5,12
Troponinele I şi T reprezintă markerii serologici preferaţi pentru diagnosticul necrozei miocardice, ţinând cont că mioglobina şi creatifosfokinaza pot fi elevate datorită rabdomiolizei.1
Ecocardiografia este utilă în diagnosticul ischemiei miocardice, însă aprecierea tulburările de contractilitate poate fi îngreunată de prezenţa hipertrofiei ventriculare stângi la 44% din consumatorii cronici de cocaină.1,6
Coronarografia arată prezenţa aterosclerozei, de obicei unicoronariană, la 31-67% din pacienţii cu infarct miocardic indus de cocaină.10 Incidenţa anevrismelor coronariene este neobişnuit de mare (30,4% faţă de 0,3-4,9% în populaţia generală).13
În afara diagnosticului de infarct miocardic, trebuie precizată relaţia cu consumul de cocaină. Anamneza trebuie să includă întrebări despre consumul de cocaină, ţinând cont că menţionarea spontană a acestuia este rară.
Studiile arată că riscul de infarct miocardic este maxim în prima oră după utilizarea cocainei: un survey efectuat pe 3946 pacienţi cu infarct miocardic recent raportează la consumatorii de cocaină un risc incredibil de infarct în prima oră de 24 de ori mai mare faţă de populaţia generală.14 Două treimi din cazurile de infarct miocardic apar în primele 3 ore după consum, însă alte studii raportează majoritatea cazurilor la 12-18 ore după consum.1,9 Având în vedere că timpul de înjumătăţire a cocainei este de 75-90 de minute, se consideră că infarctele apărute după mai multe ore sunt datorate metaboliţilor activi ai cocainei, benzilecgonină şi metilesterecgonină, care persistă până la 48 de ore în sânge.9 Dealtfel strategia diagnostică pentru infarctul indus de cocaină include determinarea urinară a benzilecgoninei care trebuie să fie > 300 ng/ml.1
Tratamentul infarctului indus de cocaină
Infarctul miocardic asociat cu cocaina se tratează asemănător cu infarctul obişnuit, cu câteva excepţii.1,15
În primul rând, pacienţii cu infarct miocardic indus de cocaină, care au semne de intoxicaţie (euforie, tahicardie ± hipertensiune) sunt trataţi cu benzodiazepine iv pentru a reduce hiperexcitaţia simpatică la nivel cerebral, lucru ce determină şi un efect benefic hemodinamic.15 Doar dacă acest tratament nu este eficient, se tratează specific hipertensiunea arterială şi tahicardia.
Nitroglicerina se indică pentru ameliorarea vasospasmului şi/sau pentru scăderea hipertensiunii, iar tratamentul antiplachetar pentru contracararea efectului protrombotic al cocainei.9
Pentru majoritatea cazurilor, este preferată reperfuzia mecanică, tratamentul trombolitic fiind rezervat pentru cazurile certe de infarct cu supradenivelare de ST, atunci când abordarea intervenţională nu este posibilă. Indicaţia de tromboliză este restrictivă, deoarece frecvent diagnosticul electrocardiografic este dificil pentru că mulţi pacienţi au repolarizare precoce (11-43% din pacinţii cu durere toracică indusă de cocaină au criterii ECG de infarct, fără însă a avea infarct), iar riscul trombolizei trebuie pus în cumpănă cu mortalitatea redusă din infarctul indus de cocaină (0-4%).1,10 Tromboliza se administrează doar după ce administrarea nitroglicerinei nu a dus la rezoluţia supradenivelării de segment ST.
Utilizarea betablocantelor în faza acută a infarctului miocardic indus de cocaină este restricţionată pentru că acestea pot accentua spasmul coronarian, dar există şi studii care contrazic această afirmaţie.1,2,15 Betablocantele sunt recomandate la externare doar la pacienţii cu indicaţie clară (disfuncţie ventriculară stângă, infarct documentat, aritmii), având în vedere riscul de reluare a consumului de cocaină şi efectul negativ al betablocantelor asupra spasmului coronarian.1
Blocanţii de calciu nu trebuie folosiţi ca primă linie de tratament, dar pot fi utilizaţi la pacienţii care nu răspund la benzodiazepine şi nitroglicerină.1
Întreruperea consumului de cocaină este pricipalul obiectiv al prevenţiei secundare. Tratarea agresivă a factorilor de risc este indicată la pacienţii cu infact şi ateroscleroză demonstrată. La aceşti pacienţi, aspirina va fi administrată pe termen lung.
Cocaina determină stimulare simpatică puternică, însoţită de tulburări hemodinamice semnificative. Cu toate acestea, incidenţa infarctului miocardic indus de cocaină este relativ scăzută. În suspiciunea de infarct, electrocardiograma şi determinarea repetată a troponinei precizează diagnosticul, iar tratamentul este similar celui a infarctului clasic, totuşi cu evitarea betablocantelor şi administrarea blocanţilor de calciu în caz de spasm. Prognosticul pe termen scurt este bun, însă cel pe termen lung este grevat de reluarea consumului de cocaină.
Bibliografie
1. McCord J, Jneid H, Hollander JE, et al. Management of cocaine-associated chest pain and myocardial infarction. A scientific statement from the American Heart Association Acute Cardiac Care Committee of the Council on Clinical Cardiology. Circulation. 2008;117:1897-190.
2. Espana Schmidt C, Pastori L, Pekler G, Visco F, Mushiyev S. Early use of beta blockers in patients with cocaine associated chest pain. Int J Cardiol Heart Vasc. 2015; 8: 167-169.
3. Wielenga V, Gilchrist D. From gold-medal glory to prohibition: the early evolution of cocaine in the United Kingdom and the United States. J R Soc Med 2013: 4(5): 1–5.
4. http://insp.gov.ro/sites/cnepss/wp-content/uploads/2016/01/Analiza-de-situatie-droguri-2016.pdf consultat pe 15.08.2017
5. Maraj S, Figueredo VM, Morris L. Cocaine and the heart. Clin Cardiol. 2010; 33 (5): 264–269
6. Brickner ME, Willard JE, Eichhorn EJ, Black J, Grayburn PA. Left ventricular hypertrophy associated with chronic cocaine abuse. Circulation. 1991; 84: 1130–1135.
7. Bădilă E, Hostiuc M, Weiss E, Bartoş D. Illicit drugs and their impact on cardiovascular pathology. Rom J Intern Med. 2015; 53(3): 218-25.
8. Qui Z, Morgan JP. Differential effects of cocaine and cocaethylene on intracellular Ca2+ and myocardial contraction in cardiac myocytes. Br J Pharmacol. 1993; 109(2): 293–298.
9. Finkel JB, Marhefka GD. Rethinking cocaine-associated chest pain and acute coronary syndromes. Mayo Clin Proc. 2011; 86(12): 1198-1207.
10. Hollander JE. Cocaine-associated myocardial infarction. J R Soc Med 1996; 89: 443-447
11. Rezkalla SH, Kloner RA. Cocaine-induced acute myocardial infarction. Clin Med Res. 2007; 5(3): 172-6.
12. Hollander JE, Lozano M, Fairweather P, et al. ‘Abnormal’ electrocardiograms in patients with cocaine-associated chest pain are due to ‘normal’ variants. J Emerg Med. 1994; 12: 199 –205.
13. Satran A, Bart BA, Henry CR, et al. Increased prevalence of coronary artery aneurysms among cocaine users. Circulation 2005; 111: 2424-2429.
14. Mittleman MA, Mintzer D, Maclure M, Tofler GH, Sherwood JB, Muller JE. Triggering of myocardial infarction by cocaine. Circulation. 1999; 99: 2737–2741.
15. Amsterdam EA, Wenger NK, Brindis RG, et al. 2014 AHA/ACC guideline for the management of patients with non–ST-elevation acute coronary syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014; 64: e139–228.

Articolul ne aduce în atenţie o patologie cu care ne confruntăm din ce în ce mai des şi punctează elementele distinctive ale acesteia. Cocaina este un drog recreaţional cu efecte simpatomimetice, a cărui utilizare, chiar ocazională, poate duce la apariţia unui sindrom coronarian acut. Utilizarea sa se asociază mai degrabă cu afectare cardiacă acută decât cronică. Consumatorii de cocaină se prezintă relativ frecvent în unităţile de primiri urgenţe cu durere toracică. În studiul COCaine Associated CHest Pain (COCHPA), infarctul miocardic a apărut la 6% din pacienţii care s-au prezentat în UPU cu durere toracică după utilizarea de cocaină. La aceştia, diagnosticul diferenţial rapid trebuie făcut între sindrom coronarian acut, aritmii, miocardită, disecţie de aortă, dar şi vasculită. Tratamentul sindromului coronarian acut indus de cocaină este acelaşi ca în orice sindrom coronarian acut, cu unele diferenţe: se evită betablocantele, se folosesc în schimb benzodiazepine intravenos pentru tratamentul tahicardiei şi anxietăţii, nu se folosesc antagoniştii de canal de calciu. Se preferă angioplastia coronariană în locul fibrinolizei, din cauza riscului crescut de hemoragie intracraniană după administrarea fibrinoliticelor la cocainomani.
Dr. Camelia Diaconu, Spitalul Clinic de Urgenţă Bucureşti
Evaluarea semnificației hemodinamice a leziunilor coronariene stabile
Autor: Dr. Răzvan Constantin Șerban, Dr. Cristina Somkereki
Institutul de Urgență pentru Boli Cardiovasculare și Transplant Tîrgu Mureș, România
Introducere
Coronarografia reprezintă în continuare “standardul de aur” pentru detectarea bolii coronariene și pentru evaluarea severității acesteia. Cu toate acestea, coronarografia reprezintă o “luminografie” și, deși oferă date importante privind aspectul și extinderea anatomică a leziunilor coronariene, rămâne o metodă subiectivă și dependentă de operator în ceea ce privește evaluarea semnificației hemodinamice a acestor leziuni.
Au fost dezvoltate o serie de tehnici anatomice pentru evaluarea severității leziunilor coronariene, de tipul Quantitative Coronary Analysis (QCA), sau tehnici imagistice, ca ecografia intravasculară (IVUS) sau tomografia prin coerență optică (OCT). Indiferent însă de metodă, între severitatea anatomică a unei leziuni coronariene și severitatea ei hemodinamică există uneori discrepanțe majore. Aceste discrepanțe se datorează mai multor factori, precum: importanța anatomică a vasului și mărimea teritoriului de miocard deservit de acesta, viabilitatea miocardului deservit, prezența circulației colaterale la acel nivel, existența unei alte artere coronariene cu ocluzie cronică și suplinirea circulației coronariene la acest nivel prin colaterale care pleacă de la nivelul vasului evaluat.
În acest context, au fost dezvoltate o serie de tehnici capabile să evalueze mult mai precis importanța funcțională a leziunilor coronariene, utile în special pentru evaluarea leziunilor stabile de severitate intermediară: rezerva fracționată de flux - FFR (fractional flow reserve), rezerva de flux coronarian - CFR (coronary flow reserve) și iFR (instant wave-free ratio) - o versiune nouă a FFR. În acest articol vom aborda câteva aspecte legate de aceste trei metode de evaluare a semnificației funcționale a leziunilor coronariene la pacienții cu boală coronariană stabilă.
Rezerva fracționată de flux – FFR (fractional flow-reserve)
Rezerva fracționată de flux este cel mai folosit parametru în momentul de față pentru evaluarea semnificației hemodinamice a stenozelor coronariene. Este un parametru ușor de înțeles conceptual și relativ ușor de determinat tehnic. Din punct de vedere practic, determinarea FFR necesită simpla măsurare a presiunilor medii proximal și distal de leziunea evaluată, în condiții de hiperemie maximă. Metoda se bazează pe principiul că, în condiții de vasodilatație maximă, relația dintre fluxul coronarian și presiunea de perfuzie este o relație liniară. Astfel, simpla calculare a raportului de presiuni va permite de fapt determinarea raportului de fluxuri proximal și distal de leziune, putând evidenția o limitare semnificativă a fluxului distal. Evident, valoarea ideală a acestui raport este egală cu 1.
Rezultatele trialurilurilor DEFER, FAME I și FAME II au impus FFR ca “standard de aur” pentru evaluarea intervențională a semnificației hemodinamice a leziunilor coronariene intermediare (reducere de lumen cu 50-70% din punct de vedere angiografic) în boala coronariană ischemică stabilă (1-3). În trialul DEFER, prezența unei stenoze semnificative (FFR < 0,75) s-a asociat cu un risc de 5 ori mai mare de a dezvolta infarct miocardic acut sau deces de cauză cardiovasculară la 5 ani.1 În același studiu, stentarea unei stenoze coronariene nesemnificative (FFR > 0,75) nu a adus beneficii prognostice sau simptomatice1. Trialurile FAME-I și FAME-II au confirmat eficiența tratamentului intervențional ghidat FFR la pacienții cu boala multivasculară, stabilind o valoare prag a FFR de 0,8.2,3 Johnson și colab. au subliniat faptul că beneficiul revascularizării este cu atât mai mare cu cât valoarea FFR este mai mică.4
Este de asemenea important de menționat faptul că evaluarea FFR poate fi utilă indiferent de tipul, localizarea sau numărul leziunilor coronariene, însă FFR nu poate fi interpretat în primele 5 zile post-sindrom coronarian acut și nu poate fi efectuat la pacienții cu contraindicații la administrarea de adenozină, agentul folosit pentru inducerea vasodilatației maxime.
iFR - instantaneous wave-free ratio
Instantaneous wave-free ratio este un parametru mai nou, derivat de fapt din FFR. Spre deosebire de FFR, are avantajul că nu necesită administrarea de adenozină intracoronarian, ceea ce permite scăderea costurilor legate de agenții farmacologici vasodilatatori, scăderea duratei intervenției și evitarea disconfortului pacientului. Principiul măsurării iFR se bazează pe faptul că în așa-numita perioadă “wave-free” din timpul diastolei, rezistența vasculară este echivalentă cu rezistența vasculară medie din timpul hiperemiei maxime. Astfel, în această perioadă, relația dintre flux și presiune este liniară, ceea ce permite, în mod similar cu determinarea FFR, evaluarea unui raport de fluxuri derivat dintr-un raport de presiuni. Cel mai frecvent, iFR se calculează ca media a 5 măsurători, deși, teoretic, o singură măsurare ar putea fi suficientă. Trialul ADVISE II a arătat că iFR este un parametru cu sensibilitate și specificitate bună, non-inferior FFR, permițând clasificarea corectă a peste 91% din leziunile coronariene la care valorile iFR au fost ≤ 0,85 sau ≥ 0,94. Pentru valori intermediare ale iFR, unde acuratețea acestuia a fost mai redusă, folosirea combinată a FFR și iFR a permis creșterea acurateții diagnostice.5 O valoare prag a iFR de 0,89 a permis clasificarea corectă a peste 82% dintre leziuni, această valoare fiind propusă pentru utilizare în practica curentă.5
Rezerva coronariană de flux – CFR (coronay flow reserve)
Perfuzia miocardică este reglată la nivelul microcirculației cu ajutorul arteriolelor, contribuția acestora la rezistența coronariană totală fiind de peste 50%.6 Capacitatea de vasodilatație coronariană poate fi evaluată indirect prin teste de stres sau măsurată prin CFR. Conceptul de CFR a fost introdus în 1974 de către Gould și colab., fiind definit ca și capacitatea fluxului coronarian de a crește în mod semnificativ în condiții metabolice particulare.7 Rezerva de flux coronarian reprezintă raportul dintre fluxul coronarian maxim în timpul hiperemiei (obținut prin administrare de adenozină intracoronarian) și fluxul coronarian bazal. Acest raport poate fi măsurat prin tehnica de termodiluție, determinând simultan, cu ajutorul unui ghid, presiunea și temperatura de la nivelul unei artere coronare. Spre deosebire de FFR, CFR depinde de o multitudine de factori, precum: fluxul coronarian bazal, presiunea arterială, frecvența cardiacă și vârsta. Mai mult decât atât, nu are o valoare normală stabilită, iar valorile obținute nu au specificitate pentru arterele coronare epicardice. Toți acești factori au limitat aplicabilitatea clinică a acestui parametru. Poate fi însă utilizat pentru a evalua funcția microvasculară, prin determinarea indexului de rezistență microvasculară (IRM), calculat ca raportul dintre presiunea coronariană distală și fluxul coronarian. O valoare crescută a IRM indică disfuncție microvasculară, putând fi folosită pentru diagnosticul anginei microvasculare la pacienți cu o valoare normală a FFR.
Bibliografie
1. Pijls NHJ, van Schaardenburgh P, Manoharan G, etal. Percutaneous coronary intervention of functionally nonsignificant stenosis: 5-year follow-up of the DEFER study. J Am Coll Cardiol 2007;49(21):2105-11.
2. van Nunen LX, Zimmermann FM, Tonino PA, etal; FAME Study Investigators. Fractional flow reserve versus angiography for guidance of PCI in patients with multivessel coronary artery disease (FAME): 5-year follow-up of a randomised controlled trial. Lancet 2015;386(10006):1853-60.
3. De Bruyne B, Fearon WF, Pijls NHJ, et al, for the FAME 2 Trial Investigators. Fractional flow reserve–guided PCI for stable coronary artery disease. N Engl J Med 2014;371:1208-17.
4. Johnson NP, Toth GG, Lai D, et al. Prognostic value of fractional flow reserve: linking physiologic severity to clinical outcomes. J Am Coll Cardiol 2014;64:1641-54.
5. Escaned J, Echavarría-Pinto M, Garcia-Garcia HM, et al., on behalf of the ADVISE II Study Group. Prospective assessment of the diagnostic accuracy of instantaneous wave-free ratio to assess coronary stenosis relevance: results of ADVISE II International, multicenter study (ADenosine Vasodilator Independent Stenosis Evaluation). JACC Cardiovasc Interv 2015;8(6):824-33.
6. Berry C. Fractional flow reserve, coronary flow reserve and the index of microvascular resistance in clinical practice. RadcliffeCardiology.com, Februarie 2014. Accesat în data de 31.07.2017.
7. Collins P. Coronary flow reserve. Br Heart J 1993;69(4):279-81.

Scurta expunere a colegilor de la Târgu Mureş asupra investigaţiilor funcţionale intracoronariene ne face o excelentă introducere în acest domeniu, ferindu-se să folosească noţiuni prea tehnice şi punând accentul pe dovezile rezultate din studiile randomizate. În practica noastră, FFR a fost relativ rar folosită, atât din cauza constrângerilor materiale legate de costul propriu zis al ghidului de presiune (“pressure guidewire”), cât şi din dificultatea de a procura adenozina, un produs altfel relativ ieftin. Din fericire, în ultimii ani a apărut noua versiune a FFR, numită iFR, cu care am apucat să ne familiarizam destul de bine. Deşi relativ greu de înţeles conceptual în lipsa unor diagrame de presiune şi a unor explicaţii destul de ample, această metodă a fost validată faţă de FFR nu numai în trialul ADVISE II menţionat de autori, dar şi în alte două trialuri publicate în acest an în New England Journal of Medicine, DEFINE-FLAIR şi iFR-Swedeheart. În practica noastră, la început, pentru a testa iniţial reproductibilitatea rezultatului, făceam până la cinci măsuratori pentru aceleaşi leziuni, obţinând rezultate aproape identice, cu variabilitate de maxim 0,01. În vasta majoritate a cazurilor am ţinut cont de rezultatul iFR în decizia de a stenta sau nu leziunea, excepţiile fiind rare şi cauzate de asocierea unor factori clinici sau angiografici speciali.
Dr. Adrian Bucşa, IUBCV “CC Iliescu”, Bucureşti
Antiinflamatoarele nesteroidiene și riscul ischemiei miocardice
Autor: Dr. Nicu Catană, Dr. Adrian Mereuţă
IUBCV “CC Iliescu” Bucureşti
Antiinflamatoarele nesteroidiene (AINS) sunt o clasă largă de medicamente cu efecte analgezice, antipiretice și antiinflamatoare, ce au o utilizare foarte răspândită, care însă prezintă o multitudine de reacții adverse.
Până în anii 2000, toxicitatea gastrointestinală a fost principalul efect advers studiat al AINS. Apariția inhibitorilor selectivi de ciclooxigenază 2 (COX-2), coxibii, a adresat specific această problemă, însă a evidențiat potențialele efecte adverse cardiovasculare pe care le posedă această clasă farmaceutică. Studiile cu rofecoxib și celecoxib au deschis o nouă zonă – cardiotoxicitatea antiinflamatoarelor nesteroidiene, ce s-a extins ulterior și către grupul de AINS neselective. Astfel, deși riscul de complicaţii gastrointestinale la AINS este mai mare decât riscul de evenimente adverse cardiovasculare, acestea din urmă sunt mult mai semnificative pentru că cresc mortalitatea pe termen scurt și induc dizabilitate pe termen lung. Studiile efectuate au demonstrat că riscul crescut de complicații aterotrombotice ale AINS are la bază un mecanism de clasă al COX-2 inhibitorilor prin supresia sintezei prostaciclinelor la nivel endotelial, fiind astfel acceptat că orice medicament inhibitor selectiv de COX-2 împărtășește această proprietate, până la proba contrarie.1 Din acest considerent, inițial rofecoxibul, iar ulterior şi alți compuși COX-2 selectivi au fost retrași de pe piață, cu excepția celecoxibului. Deși studiile au demonstrat ca dozele mari de celecoxib (>400 mg/zi) cresc riscul cardiovascular, nivelul de evidență nu a fost la fel de clar și pentru schemele terapeutice în doze mici. Având în vedere această dilemă, s-a inițiat studiul PRECISION pentru evaluarea celecoxibului vs. ibuprofen și naproxen în ceea ce privește riscul cardiovascular. Datele obținute din acest studiu sunt limitate de rata mare de întrerupere a tratamentului cu AINS în primul an (40%) și la 2 ani (peste 50%), fiind astfel dificil de evaluat dacă evenimentele cardiovasculare adverse au fost datorate medicației de studiu având în vedere neomogenitatea grupurilor după acest interval de timp. Totuși, din rezultatele preliminare ale studiului PRECISION, se poate concluziona că celecoxibul nu determină o creștere de risc cardiovascular mai mare decât naproxenul sau ibuprofenul. În condiţiile în care celecoxibul prezintă mai puține reacții adverse gastrointestinale și renale față de aceşti inhibitori neselectivi de ciclooxigenază. Există studii similare care susțin aceste rezultate – studiul SCOT nu a evidențiat diferențe de risc cardiovascular între pacienții ce au primit celecoxib față de alte AINS. Similaritatea profilului de siguranță cardiovasculară cu naproxenul, evidențiată de studiul PRECISION, permite celecoxibului să fie utilizat în prezent în tratament cronic în doze mici.2
Antiinflamatoarele nesteroidiene neselective interferează cu activitatea antitrombotică a aspirinei, pot crește numărul de evenimente cardiovasculare, agravează hipertensiunea arterială și pot exacerba decompensările insuficienței cardiace.3,4
Interferența cu efectul aspirinei
Efectul antitrombotic benefic al aspirinei în prevenția secundară a bolii cardiovasculare rezultă din acetilarea ireversibilă al sitului activ al ciclooxigenazei trombocitare. Acest efect poate fi atenuat de administrarea concomitentă de ibuprofen și naproxen.3 Astfel, utilizarea îndelungată de AINS neselective trebuie evitată, dacă este posibil, la pacienții ce primesc doze terapeutice de aspirină pentru protecție cardiovasculară.
În studii asupra subiecților sănătoși, efectul antitrombotic al aspirinei a fost atenuat de administrarea concomitentă atât a ibuprofenului, cât și a naproxenului.3,5,6 Administrarea orală de ibuprofen a determinat o dublare a producției de tromboxan B2 însoțită de creșterea agregării plachetare. Același efect s-a obținut și în cazul administrării orale de naproxen.6 Acest efect nu a fost observat în grupurile ce au primit acetaminofen sau diclofenac. Rezultatele se corelează cu studii în vitro ce au demonstrat incapacitatea aspirinei de a inhiba producția de tromboxan în cazul trombocitelor incubate anterior în medii cu naproxen sau ibuprofen.6 Mecanismul propus este cel de competiție între AINS și aspirină pentru un sit comun de legare la nivelul COX-1 ce previne legarea completă a aspirinei, având ca rezultat o acetilare deficitară a reziduului serinic de la acest nivel, o reacție ireversibilă pe toată durata de viață a trombocitului. Această interacțiune farmacodinamică nu se observă în cazul administrarii de celecoxib (AINS selectiv) sau diclofenac. Blocada trombocitară efectuată de ibuprofen și naproxen este mai slabă și inconstantă între doze în comparaţie cu blocada obținută prin administrarea constantă de aspirină.
Nu există studii clinice randomizate asupra acestui subiect. Studiile observaționale au evidențiat rezultate discordante, unele studii aratând o creștere a riscului cardiovascular prin asocierea aspirinei cu ibuprofen, în timp ce alte studii nu au evidențiat diferențe între cele 2 grupuri.7-9
Cele mai multe date existente în literatură în acest moment asupra interferenței dintre aspirină și alte AINS în contextul prevenției cardiovasculare provin dintr-o analiză de subgrup dintr-un studiu randomizat cu o durată de 5 ani ce a inclus 22.000 de subiecți aparent sănătoși.10 Astfel, o doză de 325 mg de aspirină zilnic a determinat o reducere de 44% a riscului apariției primului infarct miocardic în cadrul acestei populații (cu risc scăzut cardiovascular). Între cei tratați cu aspirină, utilizarea concomitentă de AINS > 60 de zile pe an a fost asociată cu o creştere semnificativă a riscului de infarct miocardic. În contrast, nu a existat o creștere semnificativă de risc cardiovascular în grupul ce a primit AINS < 60 de zile cumulat pe an.
AINS neselective și riscul cardiovascular
Utilizarea AINS neselective se asociază cu o creștere a evenimentelor adverse cardiovasculare, riscul absolut fiind mic. Totuşi, este de menționat că există o creştere liniară a riscului la doze mai mari sau prin creșterea frecvenței de administrare.11 Naproxenul pare să fie cel mai sigur din acest punct de vedere, cu toate că şi el creşte riscul crescut de infarct miocardic sau accident vascular cerebral.12 Există date insuficiente pentru a ghida utilizarea de AINS în cadrul pacienților cu risc cardiovascular scăzut, pacienți la care raportul risc-beneficiu este mic. Se consideră astfel sigură utilizarea de naproxen în cea mai mică doză eficientă la acești pacienți, efectele cardiovasculare adverse fiind neglijabile,
Efectele AINS asupra riscului cardiovascular au fost cel mai bine ilustrate într-o metaanaliză bazată pe 31 de studii randomizate ce au inclus 3 tipuri de AINS neselective și 4 tipuri de AINS COX-2 selective asupra unui total de 116.429 de pacienți urmăriți pe parcursul unui an.13 Administrarea de AINS neselective a evidențiat, faţă de placebo, un risc crescut de infarct miocardic și risc combinat crescut de infarct miocardic și accident vascular cerebral, cu un risc mai mic în cazul administrării de naproxen față de ibuprofen sau diclofenac. Rezultate similare au fost evidențiate la pacienții cu boală coronariană ischemică. Într-o cohortă de 83.677 de pacienți danezi ce au supraviețuit unui infarct miocardic, riscul de mortalitate și de infarct miocardic recurent a fost mai mare în subgrupul ce a utilizat AINS față de cei ce nu au utilizat această medicație.11 Riscul cel mai mare a fost în cadrul administrării de diclofenac și ibuprofen, cu un risc mai mic în cadrul administrarii de naproxen. Creșterea absolută de risc a fost mică, însă semnificativă statistic.
Bibliografie
1. Patrono C. Cardiovascular effects of cyclooxygenase-2 inhibitors: a mechanistic and clinical perspective. Br J Clin Pharmacol 2016; 82: 957–964.
2. David T. Felson, M.D., M.P.H. Safety of Nonsteroidal Antiinflammatory Drugs. N Engl J Med 2016; 375(26): 2595-6.
3. Catella-Lawson F, Reilly MP, Kapoor SC, et al. Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med 2001; 345:1809.
4. García Rodríguez LA, Varas-Lorenzo C, Maguire A, González-Pérez A. Nonsteroidal antiinflammatory drugs and the risk of myocardial infarction în the general population. Circulation 2004; 109:3000.
5. MacDonald TM, Wei L. Effect of ibuprofen on cardioprotective effect of aspirin. Lancet 2003; 361:573.
6. Capone ML, Sciulli MG, Tacconelli S, et al. Pharmacodynamic interaction of naproxen with low-dose aspirin în healthy subjects. J Am Coll Cardiol 2005; 45:1295.
7. Loll PJ, Picot D, Garavito RM. The structural basis of aspirin activity inferred from the crystal structure of inactivated prostaglandin H2 synthase. Nat Struct Biol 1995; 2:637.
8. Kimmel SE, Berlin JA, Reilly M, et al. The effects of nonselective non-aspirin non-steroidal antiinflammatory medications on the risk of nonfatal myocardial infarction and their interaction with aspirin. J Am Coll Cardiol 2004; 43:985.
9. Curtis JP, Wang Y, Portnay EL, et al. Aspirin, ibuprofen, and mortality after myocardial infarction: retrospective cohort study. BMJ 2003; 327:1322.
10. Kurth T, Glynn RJ, Walker AM, et al. Inhibition of clinical benefits of aspirin on first myocardial infarction by nonsteroidal antiinflammatory drugs. Circulation 2003; 108:1191.
11. Schjerning Olsen AM, Fosbøl EL, Lindhardsen J, et al. Duration of treatment with nonsteroidal antiinflammatory drugs and impact on risk of death and recurrent myocardial infarction în patients with prior myocardial infarction: a nationwide cohort study. Circulation 2011; 123:2226-35.
12. Watson DJ, Rhodes T, Cai B, Guess HA. Lower risk of thromboembolic cardiovascular events with naproxen among patients with rheumatoid arthritis. Arch Intern Med 2002; 162:1105.
13. Trelle S, Reichenbach S, Wandel S, et al. Cardiovascular safety of non-steroidal antiinflammatory drugs: network meta-analysis. BMJ 2011; 342:c7086.

Antiinflamatoarele nesteroidiene (AINS) reprezintă prima alegere în tratamentul durerii acute şi/sau cronice. Siguranţa cardiovasculară a AINS constituie o problemă importantă de sănătate publică, întrucât utilizarea acestei clase terapeutice se intensifică paralel cu creşterea în vârstă a populaţiei.
Numeroase studii au demonstrat că dezechilibrul prostanoidelor hemostatice ar fi implicat în creşterea riscului de evenimente trombotice cardiovasculare (infarct miocardic acut, accident vascular cerebral). Pacienţii cu risc de a dezvolta reacţii adverse sunt cei cu afectare arterială patentă (coronariană, cerebrală, periferică).
FDA (Food and Drug Administration) şi EMA (European Medicine Agency) recomandă ca AINS să fie prescrise în doza minimă eficientă şi pe durata cea mai mică necesară pentru atingerea obiectivului terapeutic şi individulizarea tratamentului. Alegerea AINS va fi ghidată funcţie de riscul cardiovascular şi gastrointestinal al pacientului. Se va evita recomandarea de AINS la pacienţii cu hipertensiune arterială rezistentă la tratament, boală coronariană ischemică, insuficienţă cardiacă decompensată, afectare renală, diselectrolitemie sau populaţia geriatrică.
Selecţionarea adecvată a unui AINS implică mai mult decât alegerea unei denumiri comerciale, fiind necesară opţiunea informată referitoare la administarea unei anumite substanţe, fundamentată pe patologia pacientului, a comorbidităţilor asociate, precum şi o bună cunoaştere a balanţei risc-beneficiu.
Educaţia pacientului reprezintă o componentă importantă a managementului terapeutic prin creşterea aderenţei la tratament, evitarea automedicaţiei şi diminuarea complicaţiilor.
Conf. Dr. Ciprian Rezuş - Spitalul Clinic Judeţean de Urgenţe "Sf.Spiridon" Iaşi
Durerea toracică la femei
Autor: Dr. Gabriela Bicescu
Spitalul Universitar de Urgenţă Bucureşti
Durerea toracică este un simptom frecvent, obișnuit și întalnit de foarte multe ori în serviciile de urgență. Ea poate avea origine cardiacă – ischemică sau nonischemică, sau noncardiacă. Cauzele și mecanismele durerii toracice sunt relativ diferite între prersoanele tinere și cele peste 50 ani. Implicaţiile sociale și profesionale sunt importante, ca și resursele consumate pentru diagnosticul acestora.
Durerea toracica anterioară la femei ridică frecvent probleme deosebite :
- Femeile fac deseori dureri atipice și sunt astfel abordate uneori mai puţin agresiv din punct de vedere al diagnosticului comparativ cu barbații; primesc deseori ca recomandare anxiolitice sau trimiteri la consulturi de psihiatrie.
- Chiar și făra o primă dovada de ischemie, repetarea durerilor conduce la spitalizari și la explorări multiple (coronarografii repetate alături de alte explorări mai mult sau mai puţin invazive pentru un diagnostic cert).
Datele din literatura arată că atunci când simptomele sunt tipice și se diagnostichează boala coronariană obstructivă, femeile sunt tratate la fel de agresiv ca și barbații.
- Comorbiditațile, stările de anxietate, depresia, atacurile de panică asociate durerii toracice o pot agrava și totodată pot întărzia un diagnostic corect.
- Deși prevalenţa anginei este mai mare la femei (angina tipică sau atipică), incidența aterosclerozei și a bolii coronariene obstructive este mai mică comparativ cu bărbații.
Totuși, prognosticul femeilor diagnosticate cu boala cardiacă ischemica este net defavorabil comparativ cu barbații.1
Durerea toracică de origine cardiaca la femei are drept cauze cel mai frecvent:
- Angina pectorala stabilă sau instabilă
- Infarctul miocardic acut, cu o prevalență care crește cu vârsta și deseori asociază un risc crescut.2-4
- Prolapsul de valva mitrala, anomalii cardiovasculare mai putin obișnuite5-9
- Pericardita, tamponada cardiacă, disecţia de aortă
- Disecția spontană de artere coronare, cauză rară de infarct miocardic intâlnită la femei, uneori la gravide, sau pacienți tineri făra factori de risc tradiționali asociați.8,9
- Broken heart syndrome- Takotsubo cardiomiopathy- cardiomiopatia indusă de stres este o cauză de supradenivelare acută de segment ST care apare în absența unor leziuni semnificative angiografic, precipitată de stresul psihic și/sau fizic intens, mai frecventă la femei postemenopauză și care debutează deseori cu tablou de șoc cardiogen, dar la care recuperarea este în general integrală în maxim 4 saptamani.5,6
- Durerile toracice din miocardite, cardiomiopatii peripartum sau post partum
- Durerile toacice cu coronare normale angiografic: o treime din femeile cu durere toracică, coronare normale şi disfuncţie endotelială dezvolta boala coronariană obstructivă în urmatorii 10 ani.3,7
Mecanimele implicate în fiziopatologia bolii coronariene la femei:
- Disfuncția endotelială poate explica simptomatologia atipică fiind responsabilă de ischemia miocardică aparută în absența stenozelor coronariene epicardice. Reversibilitatea disfuncției endotelale ar putea constitui o țintă terapeutică cu viza scăderii riscului de evenimente ischemice ulterioare.13
- Disfuncția microvasculară non- endotelial dependentă- observată mai frecvent la femei în postmenopauză: este o vasculopatie care afectează întreaga circulație coronariană și care se adaugă disfuncției endoteliale.
- Artere coronare subțiri comparativ cu bărbații, ceea ce conduce mai ușor la stenoză sau disfuncție endotelială.1
- Eroziunea plăcii cu cascada ulterioară de formare a trombului este de doua ori mai frecventă la femei
- Remodelarea pozivă (exterioară) diagonsticată prin ecografia intravasculara , poate explica procentul crescut de artere coronare normale angiografic.
Durerea toracică de origine noncardiacă:
- Dureri de tip ulceros: ulcer gastric/duodenal, gastrite, boala de reflux, hernie hiatala
- Dureri toracice de cauză osteo-articulară: dureri iradiate de la nivelul colonei cervico-toracale cel mai frecvent în cadrul bolii atrozice sau afectări articulare în boli de sistem, dureri de tip nevralgic, herpes zoster, tendinite, nevrite sau miozite de cauze diverse, dureri osoase secundare în neoplaziii sau hemopatii
- Dureri toracice în pneumonii, pleurezii, pneumotorax10
- Dureri toacice in anemii
- Dureri toracice cel mai frecvent precordiale din sindroamele anxioase, depresie, atacuri de panică11
Algoritmul de evaluare al durerii toracice :
- Anamneză, factori de risc, istoric familial, condiții de viată și muncă
- ECG de repaus și test ECG de efort când suspiciunea de boală coronariană este înaltă
- Când testul de efort nu poate fi efectuat sau este nondiagnostic, alte teste de stres: ecocardiografie, scintigrafie miocardică, angio CT, RMN cardiac
- Angiografie coronariană atunci cand testul de stres este pozitiv
În concluzie, circa jumătate din durerile toracice la femei au o cauză cardiacă deși modalitatea de prezentare poate fi deseori atipică, necesitand un diagnostic atent pentru a permite un tratament corect şi complet.
Bibliografie
1. Bairey Merz CN. Women and Ischemic Heart Disease: Paradox and Pathophysiology. J Am Coll Cardiol Img 2011; 4: 74-77.
2. Banks K, Puttagunta D, Murphy S et al. Clinical characteristics, vascular function and inflammation in women with angina in the absence of coronary atherosclerosisȘthe Dallas Heart Study. J. Am. Coll Cardiol Img 2011; 4: 65-73
3. Viola Vaccarinno. Ischemic heart disease. Many Questions , Few Facts. Circ Cardiovas Qual Outcomesc. 2010; 111-115.
4. N. B. Merz. The Yentl syndrome is alive and well. Eur. Heart J 2011; 32(11): 1313 - 1315.
5. Bybee KA, Prasad A, Barsness GW, et al. Clinical characteristics and thrombolysis in myocardial infarction frame counts in women with transient left ventricular apical ballooning syndrome. Am J Cardiol. 2004; 94(3):343-6
6. Khallafi H, Chacko V, Varveralis N, et al. "Broken heart syndrome": catecholamine surge or aborted myocardial infarction? J Invasive Cardiol 2008;20(1):E9-13
7. Roger V, Farkouh M, Weston S et al. Sex differences in evaluation and outcome of unstable angina. JAMA 2000; 283:646-652
8. DeMaio S, KinsellaS, Silverman M. Clinical course and long-term prognosis of spontaneous dissection. Am J Cardiol 1989; 64: 471-5
9. Zupan I, Noc M, Trinkaus D et al. Double vessel extension of spontaneous coronary artery dissection in young women treated with trombolisis. Catheter Cardiovasc Interv 2001; 52: 226-6.
10. Lenfant C. Chest pain of cardiac and noncardiac origin. Metabolism, 2010 oct, Supl1 S 41-6.
11. Atoosheh Rohani, Vahid Akbari,1 and Fahimeh Zarei1. Anxiety and Depression Symptoms in Chest Pain Patients Referred for the Exercise Stress Test. Heart Views 2011; 12(4): 161-164
12. Bellasi A et al. New insights into ischemic heart disease in women. Cleveland Clin J Med 2007; 74: 585-594.
13. Pepine CJ, Anderson RD, Sharaf BL, et al. Coronary microvascular reactivity to adenosine predicts adverse outcome in women evaluated for suspected ischemia; results from the National Heart, Lung and Blood Institute WISE (Women’s Ischemia Syndrome Evaluation) study. J Am Coll Cardiol 2010; 55: 2825-32.

Diagnosticul durerii toracice anterioare la femei este o problemă relativ dificilă dat fiind diversitatea condițiilor care le poate produce. Incidența din ce în ce mai mare a bolii coronariene la tineri, la ambele sexe, adesea cu o simptomatologie atipică sau nespecifică , implică elucidarea unui diagnostic corect de boala cardiacă sau noncardiacă.
Vârsta pacientei examinate, precizarea factorilior de risc convenționali sau rari și prezentarea tipică sau atipică a durerii pentru boala coronariană reprezintă elemente importante în diagnostic. Pentru persoanele tinere (sub 45 ani) fără factori de risc și dureri toracice nespecifice, este preferabilă o perioade de observație înainte de începerea unor teste diagnostice electrocardiografice sau ecocardiografice, posibil fals pozitive sau negative.
Înainte de evaluarea cardiovasculară la femei cu dureri toracice atipice, este necesar examenul clinic general și stabilirea contextului psihoemoţional și în care apare durerea toracică. Dacă suspiciunea clinică de boală coronară este prezentă, testele de stres reprezintă o etapă înaintea coronarografiei diagnostice
Acad. Prof. Dr. Leonida Gherasim - Spitalul Universitar de Urgenţă Bucureşti
Studiul REMOTE-PCI: intervenții coronariene percutane realizate prin intermediul unui sistem care utilizează o combinație de robotică și telecomunicații
Autor: Simina Crișan
Institutul de Boli Cardiovasculare Timișoara
Articolul luat în discuţie aduce în lumină o nouă abordare a realizării intervenţiilor coronariene percutane.1
În mod clasic, aceste proceduri sunt efectuate manual, de către un medic operator care avansează, retrage şi practică inflația și endoprotezarea prin instrumente intervenţionale la nivel coronarian, acest medic fiind localizat pe tot timpul procedurii lângă pacient.
După un prim studiu pilot efectuat în 2006 de Beyar, pe un număr redus de pacienţi, studiul PRECISE a evaluat în 2013, pe 164 de pacienţi, posibilitatea realizării acestor intervenţii coronariene percutane cu ajutorul endoprotezării (stentării) robotice, cu o rată de succes de peste 97%, sistemul robotic fiind localizat, în acest caz, în aceeaşi încăpere cu pacientul.2,3
Studiul prezentat în articolul analizat, REMOTE–PCI, este însă primul care analizează utilizarea unui sistem robotic pentru realizarea intervenţiilor coronariene percutane, un sistem manevrat de un medic operator situat într-o încăpere separată, situată la 18 metri de pacient, fără contact vizual sau audio direct, comunicarea între operator şi personalul medical din sala de cateterism nefiind posibilă decât prin intermediul unor sisteme de telecomunicaţii care au permis comunicare audio şi video. Studiul s-a desfăşurat în cadrul centrului Frederik Meijer Heart & Vascular Institute (Spectrum Health, Grand Rapids, MI, USA) şi a inclus un număr de 20 pacienţi, înrolaţi în perioada decembrie 2014 - septembrie 2015.2
După obţinerea consimţământului informat, pacienţii consideraţi eligibili au fost cei care prezentau o leziune coronariană severă, a cărei rezolvare a fost considerată fezabilă prin intermediul procedurii robotice. Criteriile de excludere au fost reprezentate de instabilitatea hemodinamică, necesitatea efectuarii PCI de urgenţă, şocul cardiogen, afectarea coronariană severă multivasculară, leziuni situate la nivelul graft-urilor coronariene, precum şi fracţia de ejecţie a ventriculului stâng sub 35%. Practic, după realizarea puncţiei arteriale şi avansarea cateterului-ghid în ostiumul coronarian, toată procedura intervenţională, adică avansarea şi retragerea ghidurilor, a baloanelor de angioplastie, precum şi a stenturilor, a fost realizată cu ajutorul sistemului robotic (CorPath ® 200; Corindus Vascular Robotics, Waltham, MA, USA).
De menţionat că pentru toţi cei 20 de pacienţi s-a utilizat abordul radial. Procedura de angioplastie a fost realizată cu success, cu ajutorul sistemului robotic prezentat, pentru 17 pacienţi (86,4%), succesul procedural fiind definit prin prezenţa unei stenoze reziduale de mai puţin de 30% la sfârşitul procedurii, în absenţa complicațiilor precum decesul sau necesitatea unei noi proceduri de revascularizare înainte de externarea pacientului.
Deşi studiul prezentat este restrâns numeric (20 pacienţi), monocentric, acesta aduce în lumină posibilitatea efectuării procedurilor intervenţionale coronariene percutane la distanţă, cu ajutorul sistemelor robotice şi de telemedicină, sisteme utilizate deja în chirurgie, în contextul în care, adresabilitatea infarctelor miocardice acute cu supradenivelare de segment ST pentru efectuarea PCI primar în timpul optim prevăzut de ghidurile în vigoare, respectiv sub 90 minute, este încă departe de a acoperi majoritatea zonelor și implicit a pacienţilor.4,5
Alte potenţiale avantaje ale acestei abordări sunt reprezentate de siguranţa oferită operatorului, din punctul de vedere al expunerii la razele X.
Cu toate acestea, desigur, sunt încă necesare studii suplimentare şi stabilirea unei curbe de învăţare pentru personalul medical care să poată efectua rutinier acest tip particular de proceduri intervenţionale, dincolo de costul ridicat al echipamentelor necesare.
Bibliografie
1. Madder RD, VanOosterhout SM, Jacoby ME, et al. Percutaneous coronary intervention using a combination of robotics and telecommunications by an operator in a separate physical location from the patient: an early exploration into the feasibility of telestenting (the REMOTE-PCI study). Eurointervention. 2017 ;12(13): 1569-1576.
2. Beyar R, Gruberg L, Deleanu D, et al. Remote-control percutaneous coronary interventions: concept, validation, and first-in-humans pilot clinical trial. J Am Coll Cardiol. 2006;47:296-300.
3. Weisz G, Metzger C, Caputo RP, et al. Safety and feasibility of robotic percutaneous coronary intervention: PRECISE (Percutaneous Robotically-Enhanced Coronary Intervention) Study. J Am Coll Cardiol. 2013;6:1596-600.
4. Marescaux J, Leroy J, Rubino F, et al. Transcontinental robot-assisted remote telesurgery: feasibility and potential applications. Ann Surg. 2002;235: 487-92.
5. Wang TY, Peterson ED, Ou F, Nallamothu BK, Rumsfeld JS, Roe MT. Door-to-balloon times for patients with ST-segment elevation myocardial infarction requiring interhospital transfer for primary percutaneous coronary intervention: a report from the national cardiovascular data registry. Am Heart J. 2011;161: 76-83.e1.

Articolul de faţă aduce în discuţie un subiect (angioplastia robotică) care a fost pentru prima dată explorat chiar în Romania în Institutul de Boli Cardiovasculare “C.C.Iliescu” în urmă cu peste 10 ani.
În anul 2005, au fost efectuate de către noi, în Bucureşti, primele 10 cazuri de PCI cu ajutorul unui sistem robotic, care este precursorul celui folosit de autorii articolului.(a se vedea referinţa bibliografică nr.2 din articol) De atunci, sistemul s-a perfecţionat şi a permis utilizarea acestuia de către cardiologul intervenţionist dintr-o locaţie la distanţă de sala de cateterism cardiac. Avantajele unui astfel de sistem constau în faptul că:
- Scade riscul de radiaţie X şi problemele de coloană ale operatorului.
- Oferă un mediu de lucru convenabil care creşte capacitatea operatorului de a efectua proceduri lungi
- Creşte precizia poziţionării stentului sau balonului, evitând implantarea de necesitate a altor stenturi
- Poate oferi date referitoare la forţele aplicate în vas – creşte siguranţa procedurii
- Poate oferi sprijin de la distanţă pentru alte centre PCI, în cazul unor proceduri dificile sau urgente, din partea unor experţi în domeniu. STEMI poate fi tratat astfel în centre PCI mai mici, cu ajutorul experţilor cu experienţă din centrele mari, prin comunicare la distanţă (telemedicina) şi utilizarea sistemului robotic de PCI.
Dr. Dan Deleanu, IUBCV “CC Iliescu” Bucureşti
IMPACTUL REGULEI TROPONINEI ÎN DIAGNOSTICUL INFARCTULUI MIOCARDIC ACUT
Autor:
Dr. Alina-Ramona Cozlac
Institutul de Boli Cardiovasculare Timişoara
Review-ul pe care il propunem se bazează pe un articol publicat în European Heart Journal din 2016, “Impact of high-sensitivity cardiac troponin on use of coronary angiography, cardiac stress testing, and time to discharge in suspected acute myocardial infarction” 32, un articol pe care îl găsim foarte util în evaluarea succintă și coerentă a bolnavilor cu suspiciune de sindrom acut coronarian evaluați în unitățile medicale de profil. Este cunoscut astăzi faptul că Troponina înalt sensibilă (hs-cTn) asigură o precizie mai mare a diagnosticului în infarctul miocardic acut comparativ cu testele convenționale ; totuși, nivele serice crescute fortuit pot determina decizii de angiocoronarografii excesive, așa zisele angiocoronarografii „albe”.
Infarctul miocardic acut (AMI) este principala cauză de deces prin boli cardiovasculare, dar și de invaliditate permanentă la nivel mondial. Diagnosticarea rapidă și precisă este esențială pentru inițierea unor tratamente eficiente, bazate pe dovezi1-3. Evaluarea clinică, efectuarea traseului ECG și prelevarea troponinei cardiace (cTn) reprezintă standardul actual în diagnosticul precoce al infarctului miocardic acut. Întârzierea recunoașterii regulei „run-in” crește în mod cert morbiditatea și mortalitatea4-5.
Recent, efectuarea troponinei cardiace înalt sensibile a fost implementată în îngrijirea clinică de rutină în Europa, Canada, Australia, Noua Zeelandă, precum și în alte țări.8-14 Troponina înalt sensibilă oferă o precizie mai ridicată pentru diagnosticul infarctului miocardic acut comparativ cu testele pentru cTn convenționale.15,18 Cu toate acestea, introducerea în clinică a fost asociată cu alte provocări, în special cu interpretarea creșterii ușoare a nivelului ei seric.8-14 Deși creșterile ușoare ale troponinei înalt sensibile pot fi datorate infarctului miocardic acut, nivele crescute ale troponinei pot fi datorate unor alte multiple cauze - aritmii cardiace, perimiocardită, criză hipertensivă, cardiomiopatie Takotsubo, embolie pulmonară, accident vascular cerebral și sepsis, sau chiar în cadrul unor suferințe cronice acutizate - insuficiența cardiacă si bolile valvulare.
Studiul APACE, un remarcabil trial multicentric internațional a încercat să demonstreze cele de mai sus.16-23 În acest studiu au fost înrolați pacienții din 3 centre, în care s-au efectuat troponina înalt sensibilă în timpul perioadei de studiu, în timp ce alte 3 spitale au continuat efectuarea unor teste de cTn convenționale. În acest studiu s-au comparat două brațe, brațul A care a inclus pacienții cu suspiciunea de infarct miocardic acut pe baza troponinei convenționale (cTnT), comparativ cu brațul B, în care au fost înrolați pacienții cu suspiciune de infarct miocardic acut, pe baza utilizării troponinei înalt sensibile (hs-cTnT). Spitalele în care nu s-au efectuat teste pentru troponina înalt sensibilă au fost utilizate ca grup de control.
Au fost înrolați pacienții cu vârstă peste 18 ani care s-au prezentat în camera de urgențe cu simptome sugestive pentru infarct miocardic acut în primele 12 ore de la debutul simptomatologiei clinice, după obținerea prealabilă a consimțământului informat. Studiul s-a desfășurat din aprilie 2006 până în iunie 2013. Pacienții care s-au prezentat de la debut cu infarct miocardic acut cu supradenivelare de segment ST precum și pacienții cu insuficiență renală în stadiul terminal, pe hemodializă nu au fost înrolați, prezentând criteriile de excludere. Studiul a fost realizat în conformitate cu principiile declarației de la Helsinki și aprobat de comisiile locale de etică.
Au fost înrolați 2544 de pacienți, din care 1455 pacienți (57%) au fost înrolați înainte (faza A), iar 1089 pacienți (43%) înainte și după (faza B) introducerea troponinei înalt sensibile. Vârsta medie a fost de 62 de ani, 32% reprezentând femei, dintre care 37% au avut un istoric de boala coronariană dovedită.
Toti pacienții au efectuat o evaluare clinică care a inclus istoricul medical, antecedente personale patologice, examenul fizic, traseu electrocardiografic în 12 derivații, puls oximetrie, testele biologice standard si radiografie toracică, în conformitate cu protocoalele locale și cu cele mai actuale ghiduri ale Societății Europene de Cardiologie.1,24
Folosind un test convențional pentru troponina cTn a fost necesară repetarea nivelului seric al troponinei dupa 6 ore, la majoritatea pacienților cu suspiciunea de infarct miocardic acut. În schimb, utilizarea troponinei înalt sensibile hs-cTnT a permis repetarea nivelului seric după 3 ore, așadar a permis excluderea rapidă a infarctului miocardic acut, conform ghidului ESC din 2011.1
Datele statistice au arătat că numărul de angiografii coronariene efectuate a fost similar între cele două perioade (23%), mai mult procentul intervențiilor coronariene percutane efectuate ulterior a fost similar (13% în ambele perioade). Intervențiile de revascularizare miocardică prin by-pass coronarian au fost, de asemenea, asemănătoare între cele două brațe (2% în ambele brațe).
La aproximativ 25% din pacienții înrolați s-au efectuat teste de stres cardiac pentru a obiectiva ischemia miocardică, la 44% dintre aceștia efectuându-se SPECT, iar la 56% din pacienți s-a efectuat testul de efort ergometric. Rata de efectuare a testului de efort cardiovascular a fost semnificativ redusă după introducerea troponinei înalt sensibile (17% dintre toti pacienții în timpul fazei A față de 9% în timul fazei B), în timp de procentul rezultatelor patologice a rămas comparabil (15% în brațul A față de 14% în faza B).
Durata timpului petrecut în departamentul de urgență în rândul tuturor pacienților a fost semnificativ redusă, cu 72 minute, după introducerea efectuării troponinei înalt senisibile (timp mediu de 377 minute în brațul A, față de 305 minute în brațul B). Durata spitalizării, cuantificată prin numărul de nopți în staționar, nu a fost semnificativ diferită între cele două faze.
Numărul pacienților externați cu diagnosticul de infarct miocardic acut a crescut semnificativ, de la 10% în brațul A, la 14% în brațul B, iar prevalența anginei pectorale instabile a scăzut de la 14% la 9%. În ambele perioade, trei sferturi din toți pacienții supuși testelor invazive au fost externati cu diagnosticul de sindrom acut coronarian, în timp ce, prevalența pacienților externați cu dureri toracice de cauze necunoscute a scăzut semnificativ.
În urma acestei analize au fost emise mai multe ipoteze. În primul rând, introducerea testelor pentru troponina înalt sensibilă nu a fost asociată cu creșterea ratei de efectuare a angiografiilor coronariene, nici cu angiografiile coronariene așa zise albe, și nici cu rata de revascularizare coronariană. În al doilea rând, testarea troponinei înalt sensibile a fost asociată cu reducerea necesității efectuării testelor de stres cardiac cu aproximativ 0.30%. Aceasta reducere a fost observată exclusiv în necesitatea efectuării testului de efort ergometric, modalitatea de stres care se aplică de obicei pacienților cu un risc cardiovascular scăzut sau moderat. La externarea pacienților din serviciul de urgență, utilizarea testelor pentru troponină a fost asociată cu o reducere semnificativă a timpului de externare, cu aproape 80 de minute, datorită timpului scurt de excludere a diagnosticului de infarct miocardic acut. De asemenea, s-a observat o reducere semnificativă a duratei de timp petrecut în departamentul de urgențe, o creștere medie de 0,63 minute/lună în timpul fazei A, comparativ cu o scădere medie de 3,27 minute/lună în timpul fazei B. Și nu în ultimul rând - costurile totale au fost, de asemenea, mult reduse, cu aproximativ 20%. La lotul de pacienți care au fost înrolați în grupul de control, în spitalele unde nu s-au efectuat teste pentru troponina înalt sensibilă nu au fost observate reducerea necesității efectuării testelor de stres cardiac sau reducerea duratei de timp până la externarea din departamentul de urgență, dar în acest lot durata de timp până la externare a crescut considerabil.
Aceste constatări confirmă precizia crescută a diagnosticului utilizând testele pentru troponina înalt sensibilă.15-23,27-30 Constatările noastre includ, de asemenea, observațiile care au reieșit dintr-un studiu pilot, care a inclus pacienți mai degrabă selectați (pacienți cu durere toracică cu probabilitate mică de a fi de origine coronariană - de exemplu, dureri toracice musculo-scheletice sau pleurale), prezentând o reducere semnificativă a efectuării testelor de stres cardiac, dar o creștere a numărului de angiografii coronariene și revascularizări percutane sau chirurgicale.31 Deoarece majoritatea pacienților înscriși în faza B au fost înrolați după publicarea ghidului ESC din 2011, studiul efectuat a investigat impactul utilizării troponinei înalt sensibile, inclusiv utilizarea percentilei 99, precum și efectuarea troponinei la 0 ore/algoritm 3 ore, cu repetare la 3 ore. În consecință, îmbunătățiri similare pot fi posibile cu alte teste pentru troponină atâta timp cât acestea pot detecta cu precizie percentila 99. Toate instituțiile participante au aplicat ghidurile ESC de bună practică clinică, care au rămas neschimbate în timpul perioadei de înscriere pentru utilizarea testelor convenționale.1,24 În plus, față de testele pentru troponină în sine, nivelurile de “cut-off” selectate pentru utilizarea clinică pot avea un impact asupra deciziilor terapeutice, precum si pentru utilizarea resurselor. Nivelul de “cut off” pentru troponina de generația a patra utilizat în timpul fazei A (40 ng/l) reprezintă nivelul de CV de 10%, și a fost recomandat de ghidurile din acel moment. 2,13 Între timp, unele spitale, în principal din USA, unde testele pentru troponină nu sunt încă disponibile, au redus nivelul de la 40 la 10 ng/l, pentru a reflecta mai bine percentila 99, fără a îndeplini criteriile de 10%.
Următoarele limitări ale studiului actual ar trebui luate în considerare : nu se știe dacă rezultatele lui pot fi extrapolate la introducerea în clinică a altor teste cu precizie diagnostică similară. 8,9,23,27 Se presupune că utilizarea testelor pentru hs-cTnI cu precizie de diagnostic similar ar trebui sa aibă ca rezultat utilizarea similară a resurselor, asa cum s-a observant în cazul hs-cTnT.
În concluzie, atunci când sunt introduse în centre experimentate, testele pentru hs-cTnT nu au fost asociate cu o utilizare crescută sau inadecvată a angiografiei coronariene. Sensibilitatea ridicată a troponinei T a fost asociată cu un proces îmbunătățit de excludere și, prin urmare, a contribuit la reducerea substanțială a necesității efectuării testelor de stress cardiac și a timpului până la externare.
Bibliografie
1. Hamm CW, Bassand JP, Agewall S, et al. ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: the task force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2011;32: 2999–3054.
2. Thygesen K, Alpert JS, White HD, et al. Universal definition of myocardial infarction. Circulation 2007;116:2634–2653.
3. Jneid H, Anderson JL, Wright RS, et al. 2012 ACCF/AHA focused update of the guideline for the management of patients with unstable angina/non-ST-elevation myocardial infarction (updating the 2007 guideline and replacing the 2011 focused update): a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2012;126:875–910.
4. Antman EM, Cohen M, Bernink PJ, et al. The TIMI risk score for unstable angina/non-ST elevation MI: a method for prognostication and therapeutic decision making. JAMA 2000;284:835–842.
5. Morrow DA, Antman EM, Charlesworth A, et al. TIMI risk score for ST-elevation myocardial infarction: a convenient, bedside, clinical score for risk assessment at presentation: an intravenous nPA for treatment of infarcting myocardium early II trial substudy. Circulation 2000;102:2031–2037.
6. Apple FS, Smith SW, Pearce LA, Ler R, Murakami MM. Use of the centaur TnI-ultra assay for detection of myocardial infarction and adverse events in patients presenting with symptoms suggestive of acute coronary syndrome. Clin Chem 2008;54: 723–728.
7. Melanson SE, Morrow DA, Jarolim P. Earlier detection of myocardial injury in a preliminary evaluation using a new troponin I assay with improved sensitivity. Am J Clin Pathol 2007;128:282–286.
8. Apple FS, Wu AH, Jaffe AS. European Society of Cardiology and American College of Cardiology guidelines for redefinition of myocardial infarction: how to use existing assays clinically and for clinical trials. Am Heart J 2002;144:981–986.
9. Twerenbold R, Jaffe A, Reichlin T, Reiter M, Mueller C. High-sensitive troponin T measurements: what do we gain and what are the challenges? Eur Heart J 2012;33: 579–586.
10. Keller T, Zeller T, Peetz D, et al. Sensitive troponin I assay in early diagnosis of acute myocardial infarction. N Engl J Med 2009;361:868–877.
11. Reichlin T, Hochholzer W, Bassetti S, et al. Early diagnosis of myocardial infarction with sensitive cardiac troponin assays. N Engl J Med 2009;361:858–867.
12. Twerenbold R, Reiter M, Reichlin T, et al. Early diagnosis of acute myocardial infarction in the elderly using more sensitive cardiac troponin assays. Eur Heart J 2011;32: 1379–1389.
13. Twerenbold R, Reiter M, Reichlin T, et al. Early diagnosis of acute myocardial infarction in patients with pre-existing coronary artery disease using more sensitive cardiac troponin assays. Eur Heart J 2012;33:988–997.
14. Reichlin T, Hochholzer W, Stelzig C, et al. Incremental value of copeptin for rapid rule out of acute myocardial infarction. J Am Coll Cardiol 2009;54:60–68.
15. Reichlin T, Irfan A, Twerenbold R, et. al. Utility of absolute and relative changes in cardiac troponin concentrations in the early diagnosis of acute myocardial infarction. Circulation 2011;124(2):136-45.
16. Rubini Gimenez M, Twerenbold R, et al. Direct comparison of high-sensitivity-cardiac troponin I vs. T for the early diagnosis of acute myocardial infarction. Eur Heart J 2014;35:2303–2311.
17. Bassand JP, Hamm CW, Ardissino D, et al. Guidelines for the diagnosis and treatment of non-ST-segment elevation acute coronary syndromes. Eur Heart J 2007;28: 1598–1660.
18. Apple FS. A new season for cardiac troponin assays: it’s time to keep a scorecard. Clin Chem 2009;55:1303–1306.
19. Goodacre S, Thokala P, Carroll C, et al. Systematic review, meta-analysis and economic modelling of diagnostic strategies for suspected acute coronary syndrome. Health Technol Assess 2013;17:v–vi, 1–188.
20. Sanchis J, Garcia-Blas S, Mainar L, et al. High-sensitivity versus conventional troponin for management and prognosis assessment of patients with acute chest pain. Heart 2014;20:1591–1596.
21. Twerenbold R, Jaeger C, Rubini Gimenez M, et al. Impact of high-sensitivity cardiac troponin on use of coronary angiography, cardiac stress testing, and time to discharge in suspected acute myocardial infarction. Eur Heart J 2016; 37: 3324–3332.
Articolul este deschis şi comentariilor Dumneavoastră (puteţi trimite comentariile la admereuta@yahoo.com cu subiectul minireview). Aceste articole sunt postate separat la rubrica Bibliotecă, sub titulatura Probleme actuale în cardiopatia ischemică, accesibilă după logare.
COMENTARII deschide comentariile primite
